Категорії новин:
Трансректальна поліфокальна біопсія під мультипараметричною ультразвуковою навігацією та ехоконтрастуванням у діагностиці раку передміхурової залози
Автор статті: О. І. Мухомор
Клінічна лікарня «Феофанія»
Рак передміхурової залози (ПЗ) – найпоширеніша солідна злоякісна пухлина у чоловіків у всьому світі з різноманітними клінічними проявами. Рак ПЗ має різні типи гістопатологічної та молекулярної гетерогенності. Теоретично одне й те саме захворювання відрізняється клінічно, починаючи від млявого – незначного раку, що вимагає активного спостереження, – до дуже агресивного зі швидким метастазуванням і летальним кінцем [7]. Це сприяє відсутності ідеального стандартизованого діагностичного процесу [1].
До 2020 р. основним протоколом діа-гностики було визначення рівня сироваткового простатспецифічного антигену (ПСА), пальцеве ректальне дослідження з наступною 12-точковою біопсією ПЗ під навігацією трансректального ультразвукового обстеження (ТРУЗО) [1-9]. Ізольоване підвищення рівня ПСА може бути єдиною причиною виконання. Однак це призводило до гіпердіагностики та гіперлікування клінічно незначимого захворювання (40-65% виконаних біопсій були надмірними) [1-5]. Багато пацієнтів без злоякісних новоутворень або з індолентним раком ПЗ піддавалися непотрібним побічним ефектам біопсії (кровотеча, біль, дизурія або інфекція). Крім того, відомо, що біопсія залишає недіагностованими 30% клінічно значущого раку ПЗ [1].
Сьогочасні дослідження в галузі візуалізації вогнищ раку ПЗ зосереджені на 2 напрямках: магнітно-резонансна томогра-фія (МРТ) та ТРУЗО. У Рекомендаціях Європейської асоціації урологів (EAU) щодо раку ПЗ 2021 [2] перед виконанням первинної або повторної біопсії рекомендується проведення мультипараметричної МРТ (мпМРТ). Однак МРТ дорожчий і менш доступний метод порівняно з ТРУЗО. Крім того, описано високу залежність результатів від досвіду фахівців, які аналізують дані мпМРТ.
Певні обґрунтовані надії пов’язані із застосуванням варіанта УЗО – УЗО з контрасвуванням. Починаючи з 2008 р., у багатьох країнах експоненційно підвищується інтерес до клінічного застосування ехоконтрастних препаратів, також швидко відкриваються нові сфери досліджень [3-6]. В цей час майже всі органи та системи можуть бути обстежені методами контрастної ехографії.
Основні переваги ехографії з контрастуванням [3-5,9]:
- висока точність диференціювання м’яких тканин у порівнянні з рутинним УЗО;
- простота контрастування;
- виключення інвазивної катетеризації, анестезії та седації;
- відсутність променевого навантаження;
- економічність дослідження;
- мінімізація обсягів ехоконтрасту (частіше 0,5-1 мл, максимально до 5 мл);
- дози внутрішньовенних контрастів складають мікрограми, що значно менше порівняно з міліграмами для інших технологій візуалізації (наприклад, контрастування МРТ);
- портативність та мобільність у використанні (можливість використання у відділеннях реанімації та інтенсивної терапії, що практично неможливо для МРТ, ОФЕКТ, КТ або ПЕТ);
- можливість обстеження хворих із великою масою;
- можливість оцінки у реальному часі системного, органного та тканинного кровотоку;
- зменшення варіабельності інтерпретації результатів;
- підвищення інформативності та ефективності діагностики.
Для контрастної ехографії використовується ехоконтрастний діагностичний препарат Соновью (Sonovue), діюча речовина - гексафториду сірки, інертний нетоксичний газ, що погано розчиняється у водних розчинах. Препарат ліцензований у Європі (Європейське агентство з лікарських засобів (EMA) у 2001 р.) та Азії [2,5].
Допоміжні речовини: макрогол 4000 – 24.56 мг, дистеароїлфосфатидихолін – 0.19 мг, дипальмітоїлфосфатидилгліцерол натрію - 0.19 мг, пальмітинова кислота – 0.04 мг.
Додавання розчину для ін’єкцій натрію хлориду 9 мг/мл (0.9%) до ліофілізованого порошку з подальшим енергійним струшуванням призводить до утворення мікробульбашок гексафториду сірки з фосфоліпідною оболонкою. Мікробульбашки мають середній діаметр близько 2.5 мкм. 1 мл препарату містить 8 мкл мікробульбашок.
Принцип резонуючої дії ехоконтрастного препарату ґрунтується на наступних акустичних ефектах:
- посилення відбитого ехосигналу;
- зменшення згасання ехосигналу;
- швидкість поширення акустичного ефекту;
- циркуляцію ЕКП в судинній системі або їх вибіркове захоплення певними тканинами [5].
Мікропухирці взаємодіють з ультразвуковим сигналом подвійним чином:
- енергія ультразвукового випромінювання руйнує мікропухирці;
- при високочастотному ультразвуковому випромінюванні мікробульбашки резонують і лопаються.
Кордон розділу фаз між бульбашкою гексафториду сірки та водним середовищем діє як дзеркало для ультразвукових променів; таким чином, підвищується ехогенність крові та збільшується контрастність між кров’ю та оточуючими тканинами. Інтенсивність сигналу, що відбивається, залежить від концентрації мікробульбашок і частоти ультразвукових променів. У рекомендованих дозах препарат викликає чітке збільшення інтенсивності сигналу протягом від 3 до 8 хв для отримання доплерівського зображення великих та дрібних судин.
З використанням традиційної технології УЗО вдається досягти посилення ультразвукового сигналу приблизно
30 дБ [5,6], що відповідає 1000-кратному посиленню. Ультразвуковий апарат дозволяє виявити цей особливий ехосигнал від мікробульбашок, незважаючи на суттєве зниження його інтенсивності (у порівнянні зі звичайним ультразвуком), і відрізнити його від лінійного сигналу тканин. Це дозволяє ефективно розділяти сигнал від контрастної речовини та сигнал від тканин.
Фармакокінетика. Загальна кількість сірки гексафториду, що міститься в клінічній дозі, надзвичайно низька (2 мл мікробульба-шок міститься 16 мкл газу). Сірки гексафторид розчиняється в крові і потім виділяється з повітрям, що видихається[5].
Середній період напіввиведення становить 12 хвилин (від 2 до 33 хвилин). Більше 80% введеної сірки гексафториду виділяється з повітрям, що видихається, протягом 2 хвилин після ін’єкції і майже 100% - протягом 15 хвилин.
Протипоказання для застосування:
- гіперчутливість до компонентів препарату;
- гострий коронарний синдром;
- клініч-но нестабільна ІХС, включаючи інфаркт міокарда, типову стенокардію спокою в останні 7 днів, значне погіршення перебігу захворювання серця в останні 7 днів, нещодавню операцію на вінцевих артеріях або інші фактори, що передбачають клі-нічну нестабільність (наприклад, недавнє погіршення показників ЕКГ);
- гостра сер-цева недостатність III-IV функціонального класу за NYHA або тяжка аритмія;
- тяжка форма легеневої гіпертензії (легеневий артеріальний тиск вище 90 мм рт. ст.);
- не-контрольована артеріальна гіпертензія та респіраторний дистрессиндром дорослих;
- пацієнти, які перебувають на штучній вентиляції легень;
- гострий період неврологічних захворювань;
- вагітність або період грудного вигодовування; дитячий вік віком до 18 років[2,5].
Побічна дія. Небажані реакції, пов’язані із застосуванням Соновью, загалом були лег-кі, короткочасні і проходили спонтанно без будь-яких небажаних наслідків. У ході 58 клінічних випробувань, у яких брали участь 4653 дорослих пацієнта, повідомлялося про головні болі (2.3%), обмежені шкірні реакції в місці ін’єкції, включаючи синці, відчуття печіння, парастезії (1.7%) та локальні хворобливі відчуття (1.4%). Були зареєстровані зміни ЕКГ, артеріального тиску та деяких лабораторних параметрів, але їх не можна вважати клінічно значущими.
Частота серйозних анафілактоїдних реакцій значно нижча, ніж у йодовмісних контр- астних препаратів (0,014%). У ультразвукових контрастних препаратів відсутня нефротоксичність і вони не протипоказані при нирковій недостатності або обструкції[3].
Тимчасові та просторові характеристики контрастування паренхіми дозволяють отримати повну характеристику осередкових уражень ПЗ. Найважливішими критеріями оцінки є:
- вираженість васкуляризації (гіпер-, ізо-або гіпоехогенне утворення порівняно з нормальною паренхімою);
- судинна архітектоніка (тобто тип сходинки чи колеса, тип кошика, периферійно-вузловий тип);
- динаміка в часі (швидка/повільна, рання/пізня).
Клінічне спостереження. Хворий Х., 74 роки. Рівень ПСА – 10 нг/мл (фізіологічні та процедурні фактори, що впливають на рівень ПСА, були відсутні). Високий рівень ПСА сироватки крові дає підстави запідозрити наявність раку ПЗ. Зазначимо вікові значення верхнього рівня загального ПСА у сироватці крові: 40-49 років - 2,5 нг/мл; 50-59 років - 3,5 нг/мл; 60-69 років - 4,5 нг/мл; понад 70 ро- ків - 6,5 нг/мл.
Значення ПСА вище вказаних значень до 10 нг/мл прийнято позначати «сірою зоною», коли важко визначити показання до проведення біопсії ПЗ. Значення ПСА вище 10 нг/мл є основою проведення біопсії ПЗ. Хворому була виконана трансректальна поліфокальна біопсія ПЗ під мультипараметричною (мп) ультразвуковою навігацією та ехоконтрастуванням Соновью (рис. 1 - 5).
Патогістологічний висновок: ацинарна аденокарцинома (Gleason Score 3 + 4 = 7) лівої частки ПЗ без лімфоваскулярної та периневральної інвазії (рис. 1-6). На закінчення відзначимо найактуальніше на тему нашої публікації. Точність діагностики доброякісної гіперплазії ПЗ за допомогою УЗО з ехоконтрастуванням склала 95,6%, а чутливість та специфічність – 95,0% та 96,7% відповідно[4].
Саме на основі аналізу результатів УЗО з ехоконтрастуванням створено спосіб прогнозування часу розвитку кастраційно-ре- зистентного раку ПЗ у процесі тривалої ан- дрогенної депривації [9].
У дослідженні [8] визначено чутливість та специфічність протоколів діагностики раку ПЗ на основі мультипараметричного УЗО з ехоконтрастуванням, мпМРТ + ТРУ- ЗО (фьюжен), мпМРТ + мпУЗО: 83,81 % та 63,92 %, 80,95 % та 62,89 %, 71,43% та 82,47% відповідно. Зазначимо, що протокол мпМРТ (3,0 Тл) представляв Т2-зважену візуалізацію високої роздільної здатності, дифузійно зважену МРТ та МРТ з динамічним контрастним посиленням.
В останніх Рекомендаціях Європейської федерації асоціацій ультразвукової діагностики в медицині та біології (EFSUMB) щодо позапечінкового застосування ультразвукових контрастних препаратів[3] зазначено, що на цей час ТРУЗО ПЗ з ехоконтрастним посиленням поки не може бути рекомендовано для рутинного клінічного використання і є областю активного наукового пошуку.
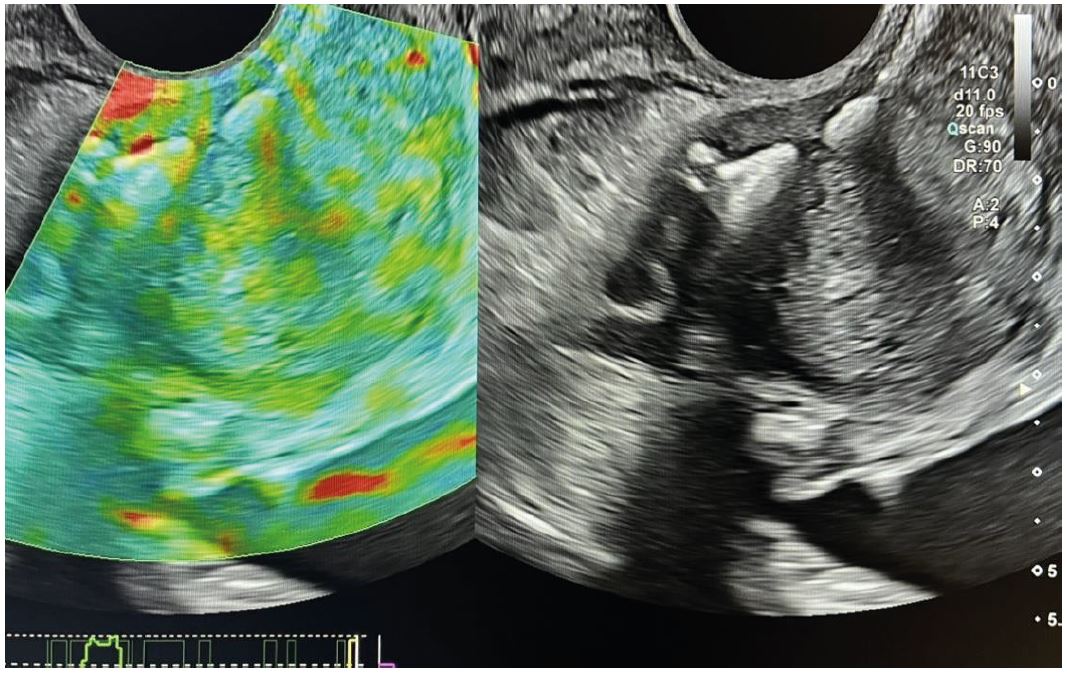
Рис. 1. Якісна еластографія.
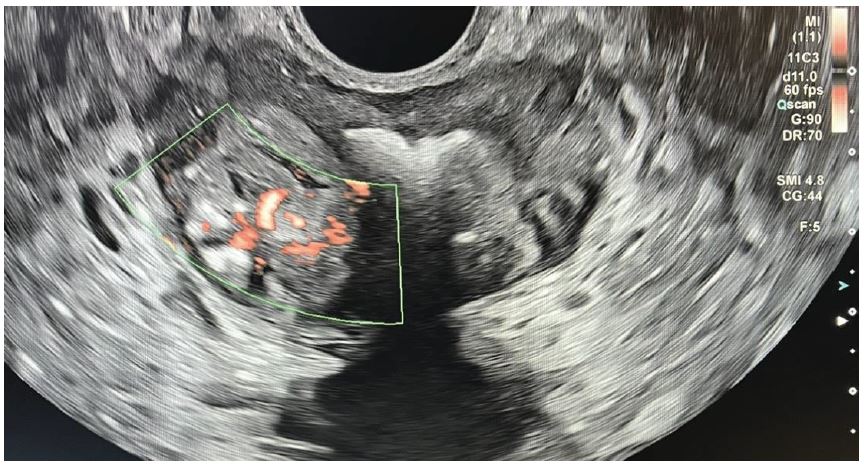
Рис. 2. Кольорова доплерографія. Аксіальне зображення.
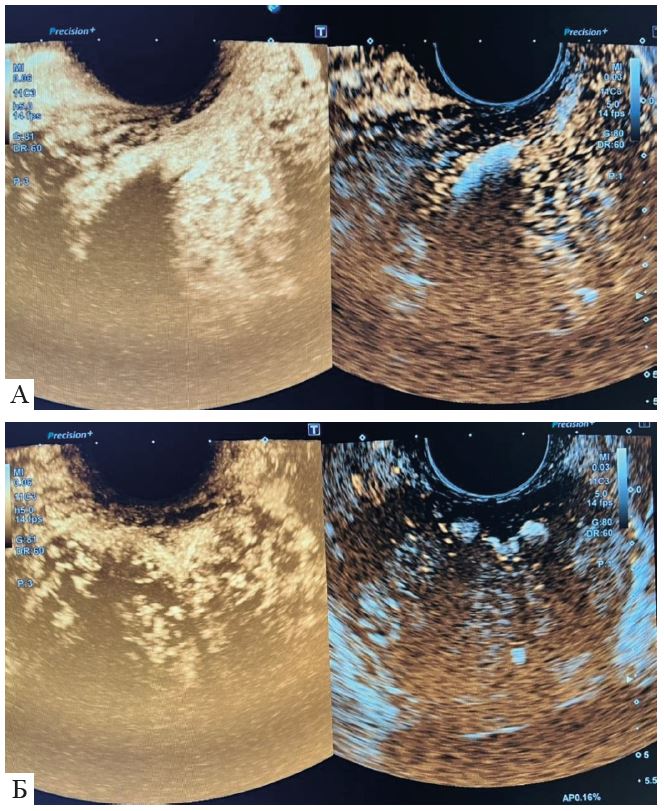
Рис. 3. Ехоконтрастування: зліва з використанням програми для контрастів; справа − В-режим; А-сагітальне зображення; Б − фронтальне зображення.
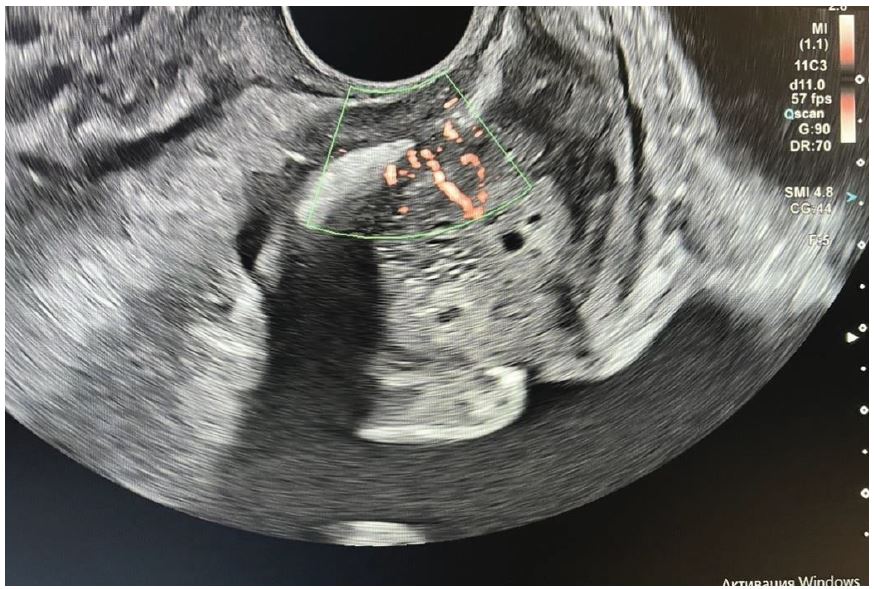
Рис. 4. Кольорова доплерографія. Сагітальне зображення.
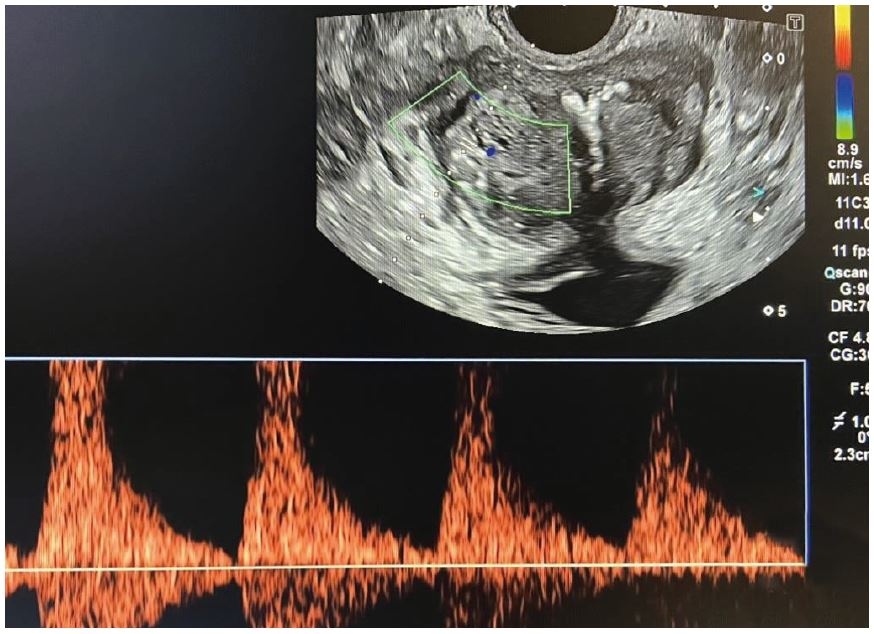
Рис. 5. Кольорова та імпульсна доплерографія.
Література
1. Gurwin A, Kowalczyk K, Knecht-Gur- win K, Stelmach P, Nowak Ł, Krajewski W, Szydełko T, Małkiewicz B. Alternatives for MRI in Prostate Cancer Diagnostics-Review of Current Ultrasound-Based Techniques. Cancers (Basel). 2022 Apr 7;14(8):1859. doi: 10.3390/ cancers14081859. PMID: 35454767; PMCID: PMC9028694.
2. Mottet N., van den Bergh R.C.N., Briers E., Van den Broeck T., Cumberbatch M.G., De Santis M., Fanti S., Fossati N., Gandaglia G., Gil- lessen S., Grivas N., Grummet J., Henry A.M., van der Kwast T.H., Lam T.B., Lardas M., Liew M., Mason M.D., Moris L., Oprea-Lager D.E., van der Poel H.G., Rouviere O., Schoots I.G., Tilki D., Wiegel T., Willemse P.M., Cornford P. EAUEANM-ESTRO-ESUR-SIOG guidelines on prostate cancer-2020 update. Part 1: screen- ing, diagnosis, and local treatment with curative intent. Eur. Urol. 2021; 79 (2): 243–262
3. Sidhu P.S., Cantisani V., Dietrich C.F., Gilja O.H., Saftoiu A., Bartels E., Ber- tolotto M., Calliada F., Clevert D.A., Cosgrove D., Deganello A., D’Onofrio M., Dru- di F.M., Freeman S., Harvey C., Jenssen C., Jung E.M., Klauser A.S., Lassau N., Meloni M.F., Leen E., Nicolau C., Nolsoe C., Pis- caglia F., Prada F., Prosch H., Radzina M., Savelli L., Weskott H.P., Wijkstra H. The EFSUMB guidelines and recommendations for the clinical practice of contrast-enhanced ultrasound (CEUS) in non-hepatic applica- tions: update 2017 (long version). Ultra- schall Med. 2018; 39 (2): e2–e44. https:// doi.org/10.1055/a-0586-1107
4. Shi J, Yin X, Xu R, Wang Y, Jin L, Gao W. Clinical application of contrast enhanced ultrasound to diagnose benign prostatic hyper- plasia. Diagn Pathol. 2014 Jul 1;9:133. doi: 10.1186/1746-1596-9-133. Retraction in: Diagn Pathol. 2015; 10: 10. PMID: 24986664; PM- CID: PMC4108000.
5. Tarighatnia, A., et al., 2022. Recent trends of contrast agents in ultrasound imag- ing: a review of the classifi and appli- cations. Materials advances, 3 (9), 3726–3741. DOI: 10.1039/D1MA00969A
6. Trabulsi EJ, Calio BP, Kamel SI, Go- mella LG, Forsberg F, McCue P, Halpern EJ. Prostate Contrast Enhanced Transrectal Ultra- sound Evaluation of the Prostate With Whole- Mount Prostatectomy Correlation. Urology. 2019 Nov;133:187-191. doi: 10.1016/j.urol- ogy.2019.07.026. Epub 2019 Aug 1. PMID: 31377256.
7. Van Poppel H, Albreht T, Basu P, Hogen- hout R, Collen S, Roobol M. Serum PSA-based early detection of prostate cancer in Europe and globally: past, present and future. Nat Rev Urol. 2022 Sep;19(9):562-572. doi: 10.1038/s41585- 022-00638-6. Epub 2022 Aug 16. PMID: 35974245.
8. Zhang X, Hong H, Liang D. The com- bined value of mpUS and mpMRI-TRUS fu- sion for the diagnosis of clinically signifi prostate cancer. Cancer Imaging. 2022 Oct 18;22(1):60. doi: 10.1186/s40644-022-00498-8. PMID: 36258247; PMCID: PMC9580162.
9. Zhao YX, Yao GL, Sun J, Wang XL, Wang Y, Cai QQ, Kang HL, Gu LP, Yu JS, Li WM, Zhang B, Wang J, Mei JJ, Jiang Y. Nomogram Incorpo- rating Contrast-Enhanced Ultrasonography Pre- dicting Time to the Development of Castration- Resistant Prostate Cancer. Clin Med Insights Oncol. 2021 Oct 8;15: 11795549211049750. doi: 10.1177/11795549211049750. PMID: 34646064; PMCID: PMC8504687.
Матеріал опубліковано з дозволу автора.
- Tags:
- Статті
- Ультразвук
Останні новини та події
