Категорії новин:
Фундус-автофлуоресценція. Ще більше про здоров'я пігментного епітелію.
З історії використання камер очного дна відомо, що обладнані фільтрами збудження та бар’єрними фільтрами для флюоресцеїнової ангіографії ретинальні камери, час від часу використовувалися для документування сильно флуоресцентних структур очей, таких як друзи зорового нерва, за допомогою плівки з високим рівнем ISO або монохромних цифрових датчиків. Через дуже низький рівень флуоресценції результати часто були суперечливими та ненадійними.
Нові технології та дослідження підштовхнули інтерес до автофлуоресцентної візуалізації очного дна (FAF) як діагностичного методу для документування присутності флуорофорів в людському оці. Флуорофори — хімічні структури, які мають флуоресцентні властивості під впливом світла відповідної довжини хвилі. Флуоресценція виникає, коли ці молекули поглинають електромагнітну енергію, яка збуджує їх до вищого енергетичного стану та викликає випромінювання світла з довжиною хвилі, довшою за джерело збудження. FAF використовується для реєстрації флуоресценції, яка може виникнути в оці природним шляхом або накопичуватися як побічний продукт процесу захворювання. Термін «автофлуоресценція» використовується для того, щоб відрізнити цей тип флуоресценції від тієї, яка виникає при введенні флуоресцентних барвників, таких як флуоресцеїн або індоціаніновий зелений. Друзи зорового нерва, астроцитарні гамартоми, пігменти ліпофусцину в сітківці та старіючий кришталик мають природну флуоресценцію.
Сучасне використання візуалізації FAF зосереджено на документуванні відкладення ліпофусцину в пігментному епітелії сітківки (RPE). Ліпофусцин — флуоресцентний пігмент, який накопичується в пігментному епітелії сітківки як метаболічний побічний продукт функціонування клітин. Відкладення ліпофусцину зазвичай збільшується з віком, але також може виникнути внаслідок дисфункції клітин пігментного епітелію сітківки або аномального метаболічного навантаження на пігментний епітелій. Домінуючим флуорофором у ліпофусцину є A2-E, сполука, яка має токсичні властивості, які можуть перешкоджати нормальному функціонуванню клітин пігментного епітелію. При збудженні коротко- та середньохвильовим видимим світлом гранули ліпофусцину автофлуоресцують, демонструючи широкий спектр випромінювання від 500 до 750 нм з піком випромінювання приблизно при 630 нм.
Запис низькорівневих флуоресцентних властивостей ліпофусцину потребує більш світлоефективного методу і зараз існують дві різні цифрові технології, які використовуються для отримання автофлуоресцентних зображень очного дна.
Автофлуоресцентне зображення ліпофусцину вперше стало практичним із запровадженням лазерної технології конфокального сканування. Лазер забезпечує дуже вузький діапазон довжин хвиль, що дозволяє ефективно збудити флуоресценцію. Конфокальна діафрагма блокує світло, що не формує зображення, від потрапляння на детектор зображення, щоб мінімізувати розсіювання та покращити контраст. Конфокальна конструкція також запобігає перешкоджанню флуоресценції в кришталику флуоресценції сітківки. Кілька кадрів фіксуються за допомогою cSLO, потім вирівнюються та усереднюються для зменшення шуму та збільшення експозиції. У техніці cSLO використовується лазер з довжиною хвилі збудження 488 нм і бар’єрним фільтром на 500 нм або 520 нм, ті самі довжини хвилі, які використовуються для флюоресцеїнової ангіографії. Через це візуалізацію cSLO FAF необхідно зробити перед ангіографією, якщо обидві процедури виконуються за допомогою cSLO під час одного візиту. Навіть найменша кількість внутрішньовенного флюоресцеїну знизить ефективність автофлуоресценції cSLO.
Для автофлуоресцентної візуалізації були розроблені нові набори фільтрів для систем на базі камери очного дна. Саме за цією технологією працюють немідріатична ретинальна камера Canon CR-2 Plus AF та комбінована ретинальна камера Canon CX-1, де використовуються високочутливі монохромні (чорно-білі) цифрові датчики разом із комбінаціями довжин хвиль, які відрізняються від тих, що використовуються для ангіографії. Монохромні датчики, як правило, вважаються кращими, ніж їхні кольорові аналоги, для ангіографії сітківки та автофлуоресценції, оскільки вони більш світлочутливі, і всі пікселі доступні для експонування відносно обмеженою смугою довжин хвиль, що генерується флуоресценцією. Техніка цифрової камери очного дна, використовує фільтр збудження з центром на 580 нм і бар’єрний фільтр з центром на 695 нм. Ці довжини хвиль зсуваються до червоного кінця спектра, щоб уникнути небажаної короткохвильової автофлуоресценції від кришталика. Зображення FAF можна проводити до або після флюоресцеїнової ангіографії за допомогою цих комбінацій фільтрів. Довжина хвилі збудження FAF 580 викликає мінімальне збудження флуоресцеїну, а бар’єрний фільтр з центром на 695 нм блокує пік випромінювання флуоресцеїну.
Смуговий діапазон фільтра збудження ретинальних камер Canon становить 535-585 нм, а бар’єрний фільтр має діапазон смугового пропускання 605-715 нм. Ці запатентовані фільтри запобігають збудженню як кришталика, так і флуоресцеїну, покращують пропускання світла та зменшують шум. Зображення FAF за допомогою цієї комбінації фільтрів також можна проводити до або після флюоресцеїнової ангіографії.
Зоровий нерв, кровоносні судини сітківки та фовеа зазвичай виглядають темними на фоні змінної флуоресценції від RPE. Відсутність RPE на голівці зорового нерва призводить до того, що він виглядає темним. Судини сітківки блокують як збудження, так і випромінювання флуоресценції від основного RPE і також виглядають темними. Щільність і морфологія пігменту в фовеа спричиняє поглинання довжин хвиль збудження, через що фовеа виглядає темнішою, ніж навколишня макула.
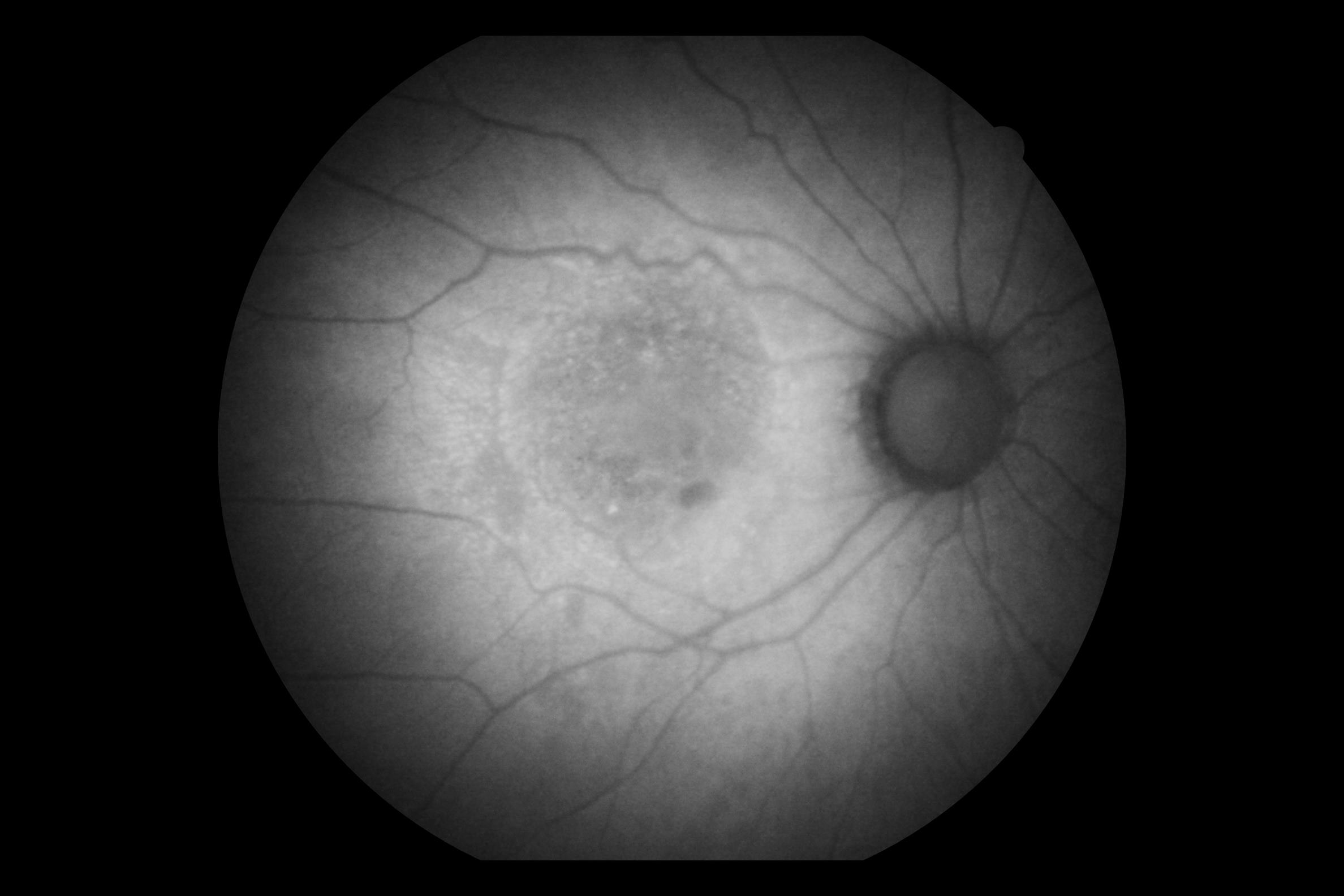
Візуалізація FAF є особливо складною через низький рівень флуоресценції та варіабельність кількості ліпофусцину, присутнього від пацієнта до пацієнта, залежно від віку, здоров’я RPE та процесу захворювання. За відсутності значного накопичення ліпофусцину недоекспонування може виникнути в розширених очах із прозорим середовищем, очах, які легко створюють добре експоновані зображення за звичайних налаштувань під час звичайної фотографії очного дна.
Cистеми візуалізації FAF вимагають значної кількості світла та збільшених налаштувань посилення для досягнення адекватної експозиції, а також піддаються небажаному шуму, який може заважати деталізації зображення. Шум — це помилкові піксельні дані, які виникають через погане співвідношення сигнал/шум і підсилення, необхідне для запису флуоресценції. Для зменшення шуму, створюваного під час захоплення, метод автофлуоресценції cSLO використовує техніку усереднення, коли кілька кадрів вирівнюються та усереднюються для отримання остаточного зображення.
У випадку ретинальних камер завданням фотокамери є спроба досягти балансу між експозицією та шумом. Хоча для досягнення достатньої експозиції можна використовувати різні комбінації налаштувань освітлення та підсилення, шум можна значно зменшити, якщо використовувати відносно низькі налаштування підсилення. Елементи керування камерою за замовчуванням для FAF зазвичай встановлюють підсилення датчика біля максимального значення, щоб записати низький рівень флуоресценції, тому може бути дуже мало місця для зменшення підсилення, щоб зменшити шум підсилювача та зберегти достатню експозицію. Якщо налаштування підсилення занадто низьке, може статися недоекспонування, що призведе до темних, низькоконтрастних фотографій. Поліпшення значно недотриманих зображень для покращення яскравості та контрасту призведе до збільшення шуму подібно до збільшення посилення.
Усі елементи керування мають бути налаштовані на максимальне пропускання світла та потужність спалаху. Пропускання світла може бути найкращим за найширшого кута в фундус-камерах зі змінним кутом. Останнє покоління наборів фільтрів значно покращує пропускання світла, дозволяючи встановлювати нижчі налаштування посилення та покращувати експозицію.
Для отримання якісних зображень FAF максимальне розширення зіниці забезпечить рівномірне освітлення та експозицію. Можна використовувати метод стереозображення, щоб додати додаткову діагностичну інформацію до метода FAF камери очного дна.
Клінічне використання
Автофлуоресцентна візуалізація може надати корисну інформацію в умовах, коли здоров’я RPE відіграє ключову роль. FAF ефективний, оскільки він може документувати метаболічні зміни внаслідок накопичення токсичних флуорофорів у пігментному епітелії сітківки.
Гіперавтофлуоресценція є ознакою підвищеного накопичення ліпофусцину, що може вказувати на дегенеративні зміни або окисне пошкодження.
Гіпоавтофлуоресценція відображає відсутність або зниження рівня нормальної флуоресценції, що проявляється темними плямами на FAF зображенні. Причиною зниження автофлуоресценції очного дна можуть бути застійні явища, загибель клітин пігментного епітелію сітківки або скупчення рідини.
Застосування візуалізації FAF було досліджено при різноманітних захворюваннях сітківки, включаючи: вікову макулярну дегенерацію, пігментний ретиніт, центральну серозну хоріоретинопатію, дистрофії жовтої плями та еластичну псевдоксантому. Роль ліпофусцину в патогенезі дегенерації макули до кінця не вивчена, але підвищена аутофлуоресценція може передувати розвитку або прогресуванню географічної атрофії при віковій макулярній дегенерації.
Крім пов’язаного з віком накопичення ліпофусцину, підвищене відкладення також відбувається при хворобі Штаргардта, дистрофії колбочок, пігментному ретиніті та хворобі Беста, що свідчить про загальний патогенетичний шлях дегенерації сітківки в цих станах.
Оскільки поточні дослідження далі визначають роль ліпофусцину в різних процесах захворювання сітківки є інтерес до використання цього методу візуалізації. Візуалізація FAF може виявитися корисною для моніторингу нових інтервенційних стратегій, спрямованих на уповільнення накопичення токсичних сполук ліпофусцину.
- Tags:
- Офтальмологія
- Статті
Останні новини та події
