Категорії новин:
Оцінка неалкогольної жирової хвороби печінки за допомогою технології атенюації (ATI)
Вступ
За статистикою, зараз у світі найбільш поширені чотири основні хвороби печінки: гепатит В, гепатит С, алкогольна хвороба печінки та неалкогольна жирова хвороба печінки (НАЖХП). Останнім часом спостерігається зростання тенденції до жирової дистрофії печінки, яка пов’язана з факторами ризику, включаючи ожиріння, діабет, гіперліпідемію та гіпертонію. Серед населення Японії від 15 до 20 мільйонів людей мають ці фактори ризику, що становить приблизно кожного восьмого серед населення, з виявленою жировою дистрофією печінки, включаючи неалкогольну жирову хворобу печінки (НАЖХП) і неалкогольний стеатогепатит (НАСГ). За оцінками, в Японії приблизно від 3 до 4 мільйонів людей мають НАСГ, і очікується, що захворюваність зростатиме.
За даними Японського діабетичного товариства, у хворих на діабет в 2-3 рази більше шансів захворіти на рак печінки. У нашому інституті ми дійшли висновку, що пацієнти з діабетом, пов’язаним із фіброзом печінки, мають вищий ризик розвитку раку печінки, особливо раку печінки, спричиненого ВГС (вірусний гепатит С). Таким чином, ми наполегливо рекомендуємо суворе спостереження за хворими на діабет з фіброзом печінки.
Наш інститут зібрав 1343 випадки ГЦК (Гепатоцелюлярної карциноми) у період з 2007 по 2016 рік. До 2010 року приблизно 20% випадків були ГЦК, не спричиненими ВГВ/ВГС, які зросли до 32% до 2017 року, подібно до світових тенденцій. Таке значне збільшення ГЦК, не спричиненого ВГВ/ВГС, пов’язане з первинним раком печінки, який розвинувся в результаті жирової дистрофії печінки. Як результат, раннє виявлення та характеристика стеатозу печінки є важливими для забезпечення кращого лікування пацієнтів. Attenuation Imaging (ATI) — це інноваційна програма, вбудована в Aplio i-series та a-series для визначення затухання ультразвукового сигналу в печінці шляхом кількісного визначення коефіцієнта затухання та демонстрації колірної карти для означення ступеня затухання. У цьому документі оцінка неалкогольної жирової хвороби печінки демонструється за допомогою технології ATI.
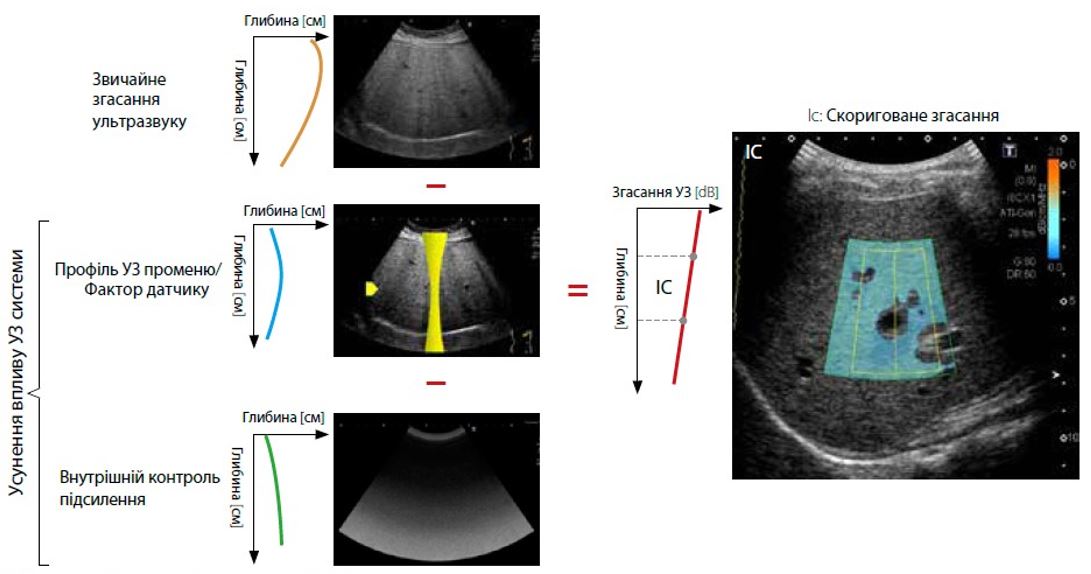
Малюнок 1 Принцип роботи атенюації (ATI)
Принцип ATI
Затухання ультразвукового сигналу залежить від структури тканин і акустичних характеристик паренхіми печінки. Ожиріння печінки пов’язане з підвищеним затуханням ультразвукового сигналу. Через зниження інтенсивності сигналу, особливо в більш глибоких областях, ожиріння печінки часто сприяє отриманню ультразвукових зображень із низькою якістю.
Щоб обчислити коефіцієнт затухання (дБ/см/МГц) за допомогою ATI, вплив системи на затухання сигналу усувається шляхом вилучення залежного від фокуса профілю УЗ променю (дБ) і внутрішнього контролю підсилення (дБ) із звичайного затухання на ультразвуковому зображенні. Скориговане затухання демонструє зміну затухання УЗ в зоні інтересу (ROI).
В ATI зміна затухання демонструється профілограмою. Кожну точку вибірки на профілограмі отримують шляхом усереднення інтенсивності на одній глибині. У пацієнтів із вищим ослабленням сигналу буде більше зменшення затухання, що призведе до більш крутого профілю лінії. Відхилення затухання пов’язане з коефіцієнтом затухання.
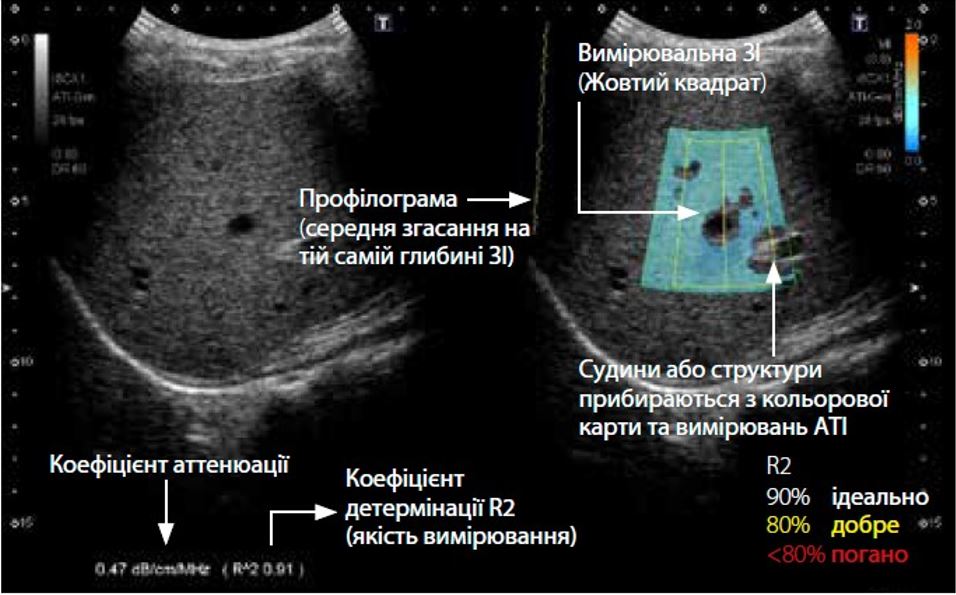
Характеристики ATI можна переглянути на зображенні з вимірюванням ATI (рис. 2). Рівень затухання позначається кольором і відображається в ROI. Області зі значними помилками обчислення затухання, такі як структури (кровоносні судини) або області з сильними артефактами (реверберація), виключаються на карті ATI. Оскільки відображаються лише надійні області для вимірювання, точне вимірювання ATI можна отримати швидко та легко. Крім того, коефіцієнт визначення (детермінації) відображається разом із коефіцієнтом затухання, що дозволяє клініцистам підтвердити оптимальне розташування для розміщення досліджуваної ділянки з метою підвищення точності.

Рівняння 1 Визначення коефіцієнта згасання
В-режим
Атенюація
Малюнок 2 Особливості вимірювання атенюації
CAP: 165 dB/m (0.47 dB/cm/MHz), ATI: 0.43 dB/cm/MHz
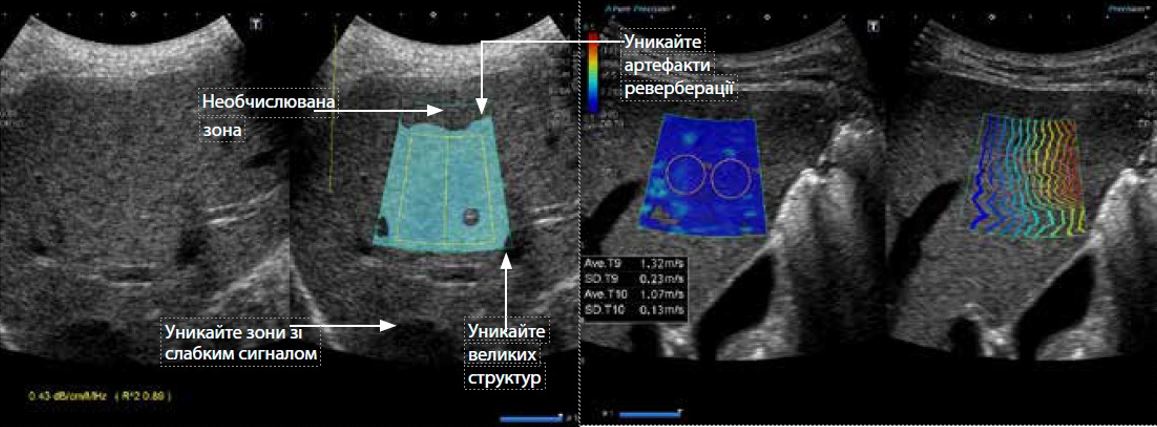
Малюнок 3 Нормальна печінка. Під час вимірювання АТІ важливо уникати ненадійних ділянок. Вимірювання АТІ та САР для нормальної печінки демонструє рівномірне згасання УЗ проміню.
Співвідношення між ATI і найсучаснішими методиками для оцінки стеатозу печінки
Були проведені клінічні оцінки для порівняння ATI з контрольованим параметром ослаблення (CAP, FibroScan®). На малюнку 3 показаний випадок з нормальною печінкою. CAP і ATI продемонстрували послідовну оцінку затухання. Щоб отримати надійні вимірювання ATI, важливо уникати ділянок з артефактами реверберації, великими структурами або ослабленими сигналами.
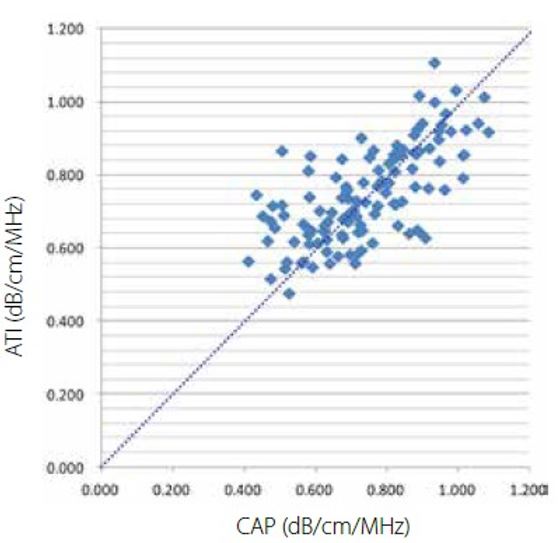
Малюнок 4 Кореляція між АТІ та САР
У 118 випадках стеатозу печінки ATI та CAP продемонстрували хорошу кореляцію (r = 0,69) (рис. 4).
На малюнку 5 показано порівняння показників ATI та CAP та КТ при легкому, середньому та важкому ожирінні печінки. Відповідно до наявних даних в літературі, у пацієнта діагностують жирову дистрофію печінки, коли коефіцієнт ослаблення печінки до селезінки (L/S) на КТ становить менше 1,0 або 1,1; а вміст жиру в печінці більше 30%. ATI та CAP демонструють чудову кореляцію зі співвідношенням на КТ L/S.
Ми досліджували зв’язок між ATI та вихідними даними пацієнта, включаючи вік, індекс маси тіла та результатів аналізу крові. На основі однофакторного та багатофакторного аналізу, ATI має статистично підтверджену різницю при оцінці стеатозу в порівннянні з B-режимом при: різній відстані від шкіри до капсули печінки та різним ІМТ.
У нашому інституті протокол оцінки ожиріння печінки в B-режимі включає сканування з постійною інтенсивністю (дБ) і динамічним діапазоном (DR) в інтеркостальному доступі. Автоматичну корекцію посилення, гамма-корекцію та компаудинг вимкнено, щоб уникнути впливу системи на згасання. Співвідношення «печінка-нирка» використовується для оцінки стеатозу печінки, і класифікація є наступною: легка жирова дистрофія печінки дає підвищену ехогенність та повне окреслення судинної системи та діафрагми; помірна жирова дистрофія печінки з частковим погіршенням віуалізації (<75%) судинної системи та діафрагми; і важка жирова дистрофія печінки з поганою візуалізацією (< 50%) судин і діафрагми. Цей діагностичний критерій співвідношення печінки та нирок має чудову кореляцію з ATI.
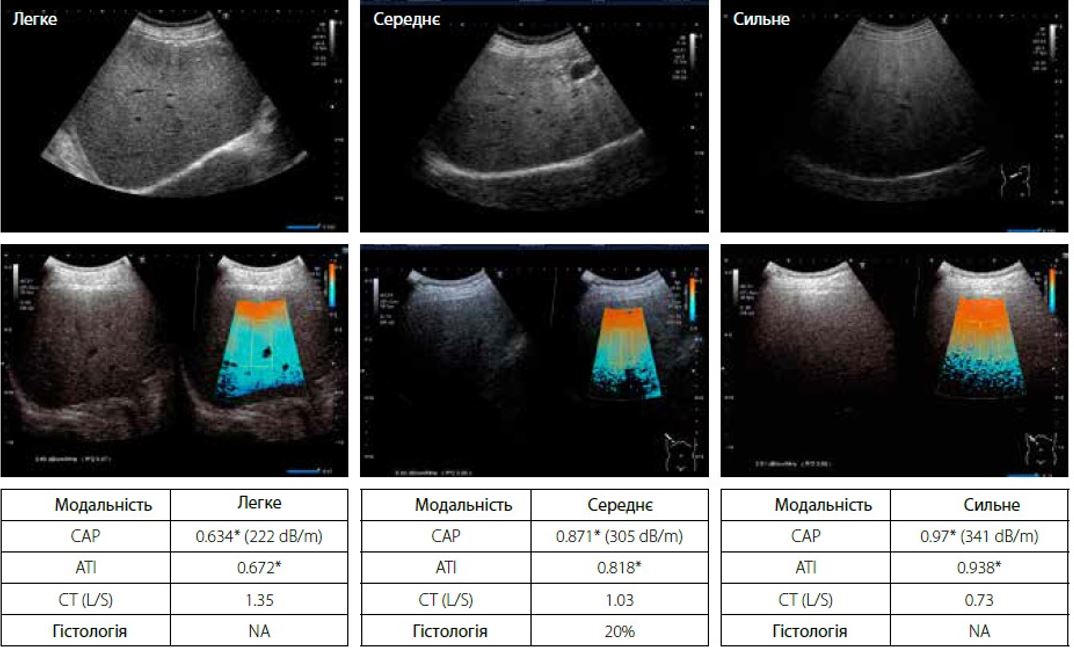
* в dB/cm/MHz. Середнє значення після 10 вимірів.
Малюнок 5 Діагностика стеатозу за допомогою АТІ, САР та СТ L/S: співвідношення при легкому, середньому та сильному ожирінні печінки
При дослідженні кореляції між CAP та ATI з гістопатологією, CAP має більшу варіативність при кількісній оцінці тяжкого ожиріння печінки. Навпаки, ATI демонструє меншу варіативність і може діагностувати дуже легкий жировий гепатоз печінки (стеатоз < 10%, гістологія). Для гістологічного стеатозу ступінь жирової дистрофії печінки класифікується як нормальний (<10%), легкий (10-33%), помірний (33-66%) і важкий (>66%) відповідно. На основі посібника з діагностики NASH/NAFLD (2015) Японського товариства гастроентерології важливо діагностувати дуже легкий стеатоз у 5-10% для раннього лікування пацієнтів. При ранньому виявленні дуже легкого стеатозу пацієнт може без проблем позбутися ожиріння печінки за допомогою фізичних вправ і дієтотерапії.
Також оцінювали кореляцію між співвідношенням КТ L/S і ATI. На КТ три досліджувані ділянки діаметром 2 см були розміщені на печінці та селезінці відповідно, щоб отримати середнє співвідношення L/S. Ожиріння печінки діагностується, коли L/S <1,0. В той же час, ATI і CAP продемонстрували хорошу кореляцію зі співвідношенням КТ L/S, і особливо ATI демонструє меншу варіативність та більш стабільний результат. При оцінці 57 випадків із співвідношенням L/S >1,0 у 10 (18%) випадках згодом було діагностовано жирову дистрофію печінки з класифікацією B-режиму, що означає, що КТ може не помітити жирову печінку.
Крім того, було оцінено зв’язок між результатами гістопатології та співвідношенням CAP, ATI та КТ L/S. У порівнянні з гістопатологією, КТ має деякі обмеження в діагностиці легкої жирової дистрофії печінки, але є надійною при діагностиці важкої стадії жирової хвороби печінки. Навпаки, ATI здатна діагностувати дуже легкий стеатоз (<10%) і легкий стеатоз (10-30%). Як наслідок, за допомогою ATI ультразвукове дослідження демонструє більший потенціал для діагностики легкого стеатозу.
Діагностика НАСГ за допомогою ATI
Останніми роками критерії класифікації НАСГ поступово оновлювалися, система Бранта, що використовує комбінацію класифікації та стадії, тепер є одним із стандартних методів класифікації НАСГ. Відповідно до «Клінічний посібник NASH / NAFLD 2015», необхідно розподілити рівні стеатозу як 5%, 20%, 40%, 60% або 80% відповідно, за шкалою, в межах якої вказується дуже легкий стеатоз.
Хоча кореляції між ступенями стеатозу при простому стеатозі та очікуваною тривалістю життя немає, повідомляється, що простий стеатоз у процесі фіброзу має переважно негативний прогноз. Іншими словами, пацієнти з НАЖХП з фіброзом потребують суворого спостереження.
Нижче наведено 2 клінічних випадки з НАСГ.
Чоловікові близько 20 років з діагнозом НАСГ при виразковому коліті (рис. 6). КТ співвідношення L/S підтвердило стеатоз. У B-режимі крапчастий малюнок паренхіми печінки не вказує на фіброз, однак початок фіброзу можна підтвердити на основі очевидного підвищення АЛТ (101 МО/л) і PLT (290 000/мкл) у аналізі крові та результатах гістології. І еластографія зсувної хвилі (1,56 м/с), і FibroScan (1,98 м/с) демонструють високе значення жорсткості печінки. Якщо рання терапія не буде проведена, прогнозується, що НАСГ переросте в цироз печінки до досягнення ним 40 років. У цьому типі випадків раннє виявлення проблеми є важливим для подальшої якості життя пацієнта.
Коли цироз печінки прогресує, ступінь стеатозу зменшується. Випадок 2 — затухаючий НАСГ у 60-річної жінки (рис. 7). НАСГ прогресував до цирозу печінки з очевидним посиленням фіброзу. При біопсії печінки у пацієнта діагностовано F4 і стеатоз 8%. Для повного обстеження висвітленого НАСГ необхідно належним чином обстежити як фіброз, так і стеатоз.
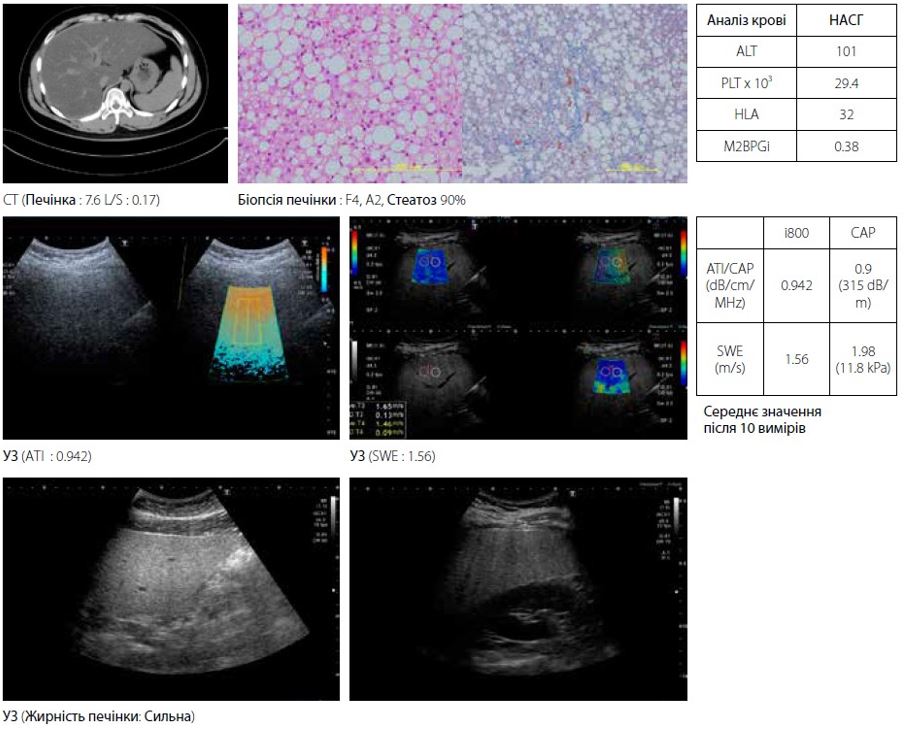
Малюнок 6 Випадок 1: НАСГ при виразковому коліті
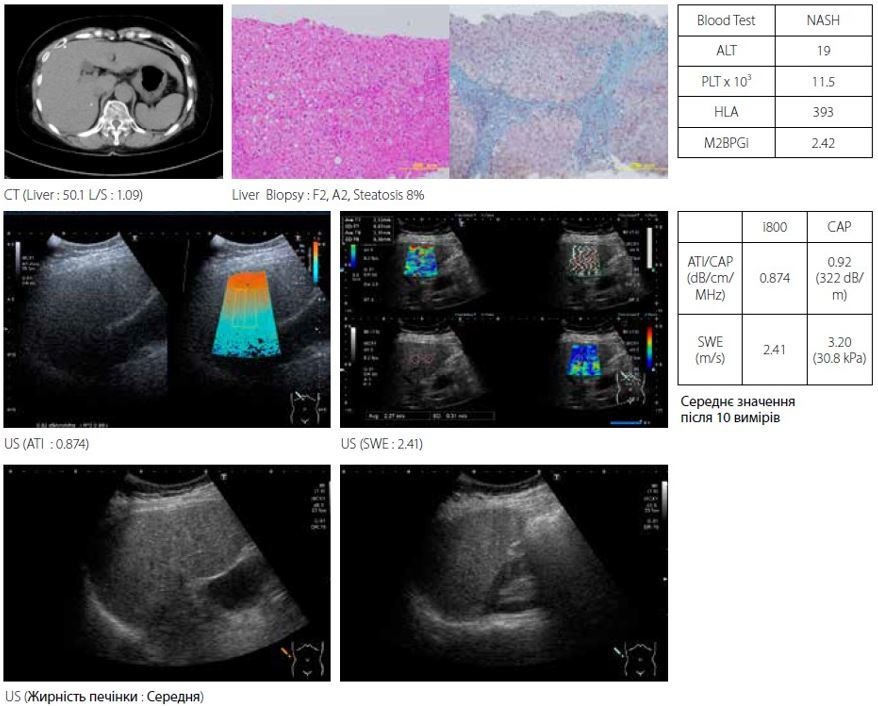
Малюнок 7 Випадок 2: 60F з підвищеною ехогенністю через НАСГ
Доцільність комплексної діагностики за допомогою ATI та еластографії зсувної хвилі (SWE)
При оцінці захворювання печінки, її жорсткість можна виміряти за допомогою SWE, а стеатоз можна визначити кількісно шляхом аналізу згасання за допомогою ATI. Завдяки всебічній оцінці за допомогою SWE та ATI можна визначити стадію фіброзу та стеатоз, що дасть змогу охарактеризувати нормальну печінку, жирову дистрофію печінки, затухаючий НАСГ та НАЖХП. Оцінка за допомогою мультипараметричної методики є важливою, оскільки для раннього виявлення захворюваності на цироз печінки критично важливо виявити стеатоз із фіброзом на початковій стадії.
Висновок
Атенюація (ATI) демонструє відмінну кореляцію з CAP і має статистично значущу різницю з класифікацією в B-режимі. Одночасно, і CAP і ATI мають сильну негативну кореляцію з КТ, яка може чітко виявити важку жирову дистрофію печінки, але діагностика легкої жирової дистрофії печінки залишається більш складною. З іншого боку, ATI здатна диференціювати легкий стеатоз (< 30%). Ультразвукове дослідження може реально забезпечити швидкий, неінвазивний, ефективний і без випромінювання метод діагностики легкого стеатозу печінки. Крім того, крім діагностики жирової дистрофії печінки, існує високий потенціал для морфологічної або гістологічної оцінки стеатозу з комплексною діагностикою за допомогою ATI та SWE на Aplio i-серії та a-серії.
Використані джерела:
1.Angulo, Paul, et al. "Liver fibrosis, but no other histologic features, is associated with long-term outcomes of patients with nonalcoholic fatty liver disease." Gastroenterology 149.2 (2015):
389- 397.
2.Aoki, Tomoko, et al. "Prediction of development of hepatocellular carcinoma using a new scoring system involving virtual touch quantification in patients with chronic liver diseases." Journal of gastroenterology 52.1 (2017): 104-112.
3.Bedossa, Pierre, Delphine Dargère, and Valerie Paradis. "Sampling variability of liver fibrosis in chronic hepatitis C." Hepatology 38.6 (2003): 1449-1457.
4.Iwasaki, Minoru, et al. "Noninvasive evaluation of graft steatosis in living donor liver transplantation." Transplantation 78.10
(2004): 1501-1505.
5.Masuzaki, Ryota, et al. "Prospective risk assessment for hepatocellular carcinoma development in patients with chronic hepatitis C by transient elastography." Hepatology 49.6 (2009): 1954-1961.
6.Park, Yang Shin, et al. "Biopsy-proven nonsteatotic liver in adults: estimation of reference range for difference in attenuation between the liver and the spleen at nonenhanced CT." Radiology 258.3 (2011): 760-766.
- Tags:
- Статті
- Ультразвук
Останні новини та події
