АКЦІЇ! ПЕРЕГЛЯНУТИ ПОВНИЙ ПЕРЕЛІК ДОСТУПНИХ ПРОПОЗИЦІЙ МОЖНА ТУТ
Категорії новин:
Сучасні методи візуалізації печінки
Вступ
Епідеміологія ГЦК
Гепатоцелюлярна карцинома (ГЦК) є 6-м найпоширенішим видом раку у світі та 2-ю основною причиною смерті від раку у всьому світі.
У США ГЦК є найбільш швидкозростаючою причиною смертності від раку, зростаючи на 2,7% на рік з 2003 до 2012 року. У всьому світі основними факторами ризику ГЦК є гепатит В (54%) і гепатит С (31%), який є причиною №1 у США.3 Цироз печінки будь-якої етіології асоціюється з ГЦК, а неалкогольний стеатогепатит (НАСГ) продовжує зростати з високою поширеністю ожиріння і метаболічних синдромів у США.4
Зниження смертності шляхом діагностики ГЦК на стадії, коли хвороба ще піддається медикаментозному або хірургічному лікуванню, потребує ефективних інструментів спостереження.
Рекомендації щодо скринінгу та спостереження за ГЦК
Ультразвук - це неінвазивний метод візуалізації, який широко використовується для оцінки захворювань печінки. Американська асоціація з вивчення захворювань печінки (AASLD) опублікувала практичні рекомендації щодо лікування ГЦК та рекомендовані групи ризику, такі як пацієнти з цирозом печінки будь-якої етіології або специфічними носіями гепатиту В були включені в програму спостереження. Ультразвукове дослідження є найкращим інструментом спостереження, що ґрунтується на результатах масштабного випадкового контрольованого дослідження, а рекомендований інтервал спостереження становить 6 місяців, виходячи з часу подвоєння ВГС.5
Рекомендації США щодо піврічного епіднагляду також підкріплені економічно ефективним аналізом. Це, мабуть, самий економічно ефективний метод епіднагляду за ГЦК.6
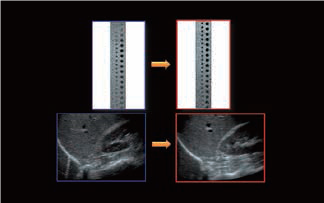
Малюнок 1. Технологія формування променя iBeam генерує клінічні зображення з вищою роздільною здатністю, більшою однорідністю та меншою кількістю артефактів, ніж звичайний промінь.
Малюнок 2. Інтелектуальна технологія динамічного мікро-зрізу (iDMS) забезпечує високу гнучкість електронного фокусування в лінзі та покращує роздільну здатність за глибиною.
Важливість якості зображень
Однією з основних проблем ультразвукового дослідження при ГЦК є коливання чутливості. Загальна чутливість УЗД для виявлення ранньої стадії ГЦК7 з розміром менше 5 см, як повідомляється, становить 63%, з діапазоном від 23% до 91%. Ультразвукове дослідження залежить від оператора, обладнання та програмне забезпечення можуть впливати на якість зображення, а також важливим фактором для якості зображення є будова тіла пацієнта. Тенденція до збільшення високого індексу маси тіла серед пацієнтів у США викликає занепокоєння. Ми провели ретроспективний аналіз 297 ультразвукових досліджень, виконаних для спостереження за ГЦК, оцінили якість зображення та дослідили фактори, що на неї впливають. Ми виявили, що майже половина ультразвукових досліджень (49,3%) мали неадекватну якість, а багатофакторний аналіз показав, що ІМТ є найбільш впливовим фактором. Збільшення ІМТ на одну одиницю на 30,8% збільшує ймовірність отримати неналежну оцінку зображень (Kono Y. et al., неопубліковані дані).
Системи Canon Aplio™ i-серії розроблені для забезпечення неперевершеної візуалізації з покращеною роздільною здатністю та глибиною проникнення для підвищення клінічної точності, діагностичної ефективності та оптимізації часу роботи лікаря. Завдяки впровадженню вдосконаленої архітектури, технології формування пучка iBeam і технології інтелектуальних динамічних мікрозрізів (iDMS) можна формувати рівномірний, однорідний і тонкий зріз, який забезпечує клінічні зображення з вищою роздільною здатністю, більшою гомогенністю і меншою кількістю артефактів. Новітні технології забезпечують покращення контрастної, часової та просторової роздільної здатності у всіх трьох площинах: осьовій, бічній та глибині.
Система Aplio i-серії оснащена ультраширокосмуговим конвексним датчиком з iDMS PVT-475BX. Ультраширокосмуговий датчик призначений для покриття частотного діапазону, який зазвичай покривається двома датчиками, щоб забезпечити як високу роздільну здатність, так і глибину проникнення.
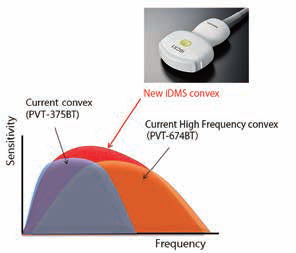
Малюнок 3. Ультраширокосмугові опуклі датчики iDMS
ТЕМАТИЧНІ ДОСЛІДЖЕННЯ
Пацієнт з ожирінням без відомих захворювань печінки (ІМТ 30)
Aplio i-серії відтворює зображення у відтінках сірого з вищою роздільною здатністю, контрастністю і глибиною проникнення. Завдяки технології iDMS, яка генерує тонкошарові зрізи, можна отримати однорідні зображення по всій глибині. Підвищена чутливість доплерівських зображень може бути продемонстрована за допомогою функції Superb Micro-vascular Imaging (SMI). SMI розмежовує низькошвидкісні мікропотоки і дозволяє візуалізувати детальну структуру судин (мал. 4).
Технічно складний пацієнт з патологічним ожирінням (ІМТ 40)
Покращення проникнення і гомогенності зображення забезпечує високу роздільну здатність у технічно складних пацієнтів. Можна чітко відобразити задню поверхню печінки та текстуру паренхіми печінки. (мал. 5).
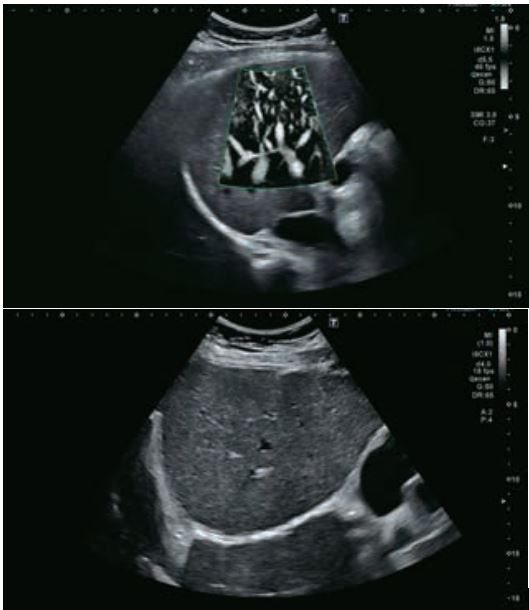
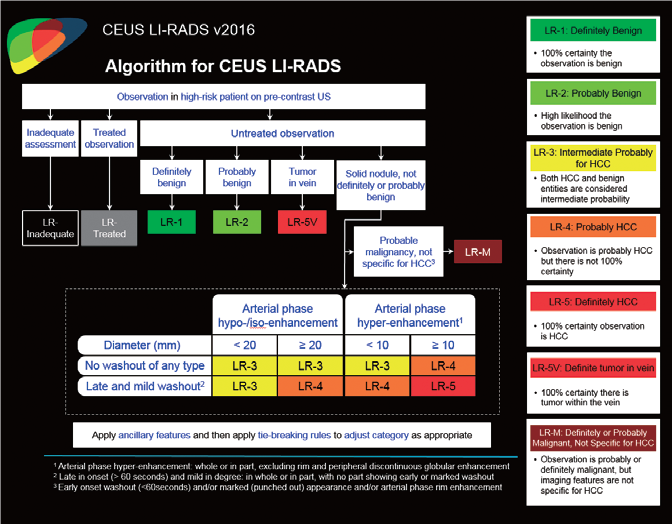
Малюнок 6. Алгоритм та класифікація CEUS LI-RADS®
ТЕМАТИЧНІ ДОСЛІДЖЕННЯ
Гемангіома
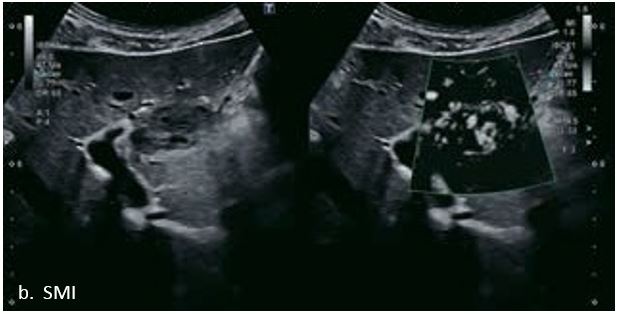
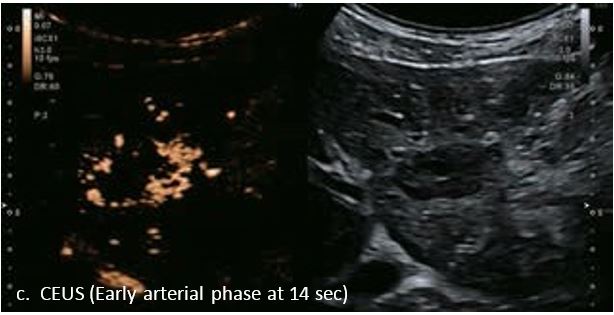
Гемангіома є одним із найпоширеніших доброякісних уражень печінки. На сірошкальному зображенні 50-річного чоловіка видно гетерогенне гіпоехогенне утворення в лівій частці печінки, розміром 3,6 см в діаметрі. На сірошкальному зображенні чітко видно межі та внутрішню структуру вогнища ураження. За допомогою SMI низькошвидкісні дрібні судини всередині вогнища можна візуалізувати з високою частотою кадрів (47 кадрів/с), а вогнище демонструє високу васкуляризацію. Вогнищеві ураження печінки чітко видно на неконтрастному УЗД з гарною якістю зображення. Васкуляризацію можна оцінити до певної міри. Однак діагноз не може бути поставлений без використання контрастної речовини. Це не є винятком для КТ чи МРТ, обидва методи потребують багатофазної візуалізації з введенням контрасту для постановки діагнозу.
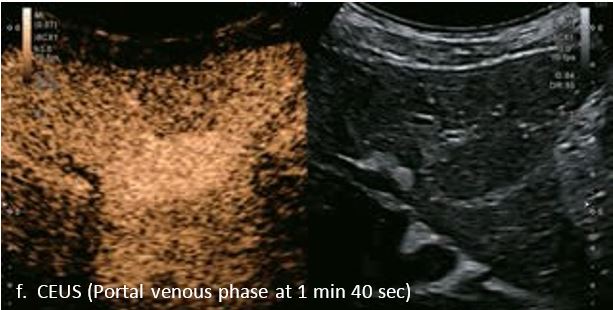
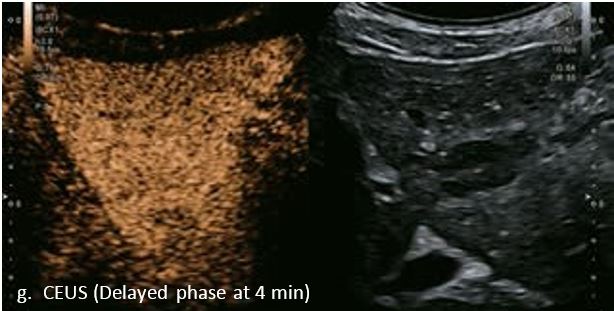
Ураження показало типову картину підсилення для гемангіоми з початковим периферичним вузловим підсиленням і доцентровим підсиленням в артеріальній фазі. Перфузію ураження можна чітко бачити на основі покращення супресії тканин за допомогою Aplio i-серії. Гемангіома продовжує демонструвати повне гіперпосилення в портальній венозній фазі і стає ізопосиленою в сповільненій фазі. Це типова картина доброякісного ураження без будь-якого типу вимивання в портальній венозній фазі або в уповільненій фазі.
Малюнок 9
Аденома печінки
Пацієнтка, 25 років, з множинними аденомами печінки. Найбільше утворення діаметром 3,5 см розташоване у шостому сегменті печінки. Хоча ураження локалізується на глибині 10 см і майже ізоехогенне до паренхіми, якість сірошкального зображення дозволяє чітко спостерігати ураження. На глибині 10 см можна легко візуалізувати гіперпосилення артеріальної фази та її судинний малюнок з периферичним, дифузним малюнком у напрямку до центру ураження. Важливо відрізнити аденому печінки від доброякісної вогнищевої вузлової гіперплазії (ВГП), оскільки ВГП має схожу візуалізацію, але посилюється зсередини назовні. Ізопосилення у портальній венозній фазі та відстроченій фазі свідчить про доброякісність ураження. Ураження з ізопідсиленням може бути важко відстежити під час пізньої портальної венозної або відстроченої фази, однак чітка візуалізація ураження на сірошкальному зображенні допомагає впевнено його відстежувати.
Малюнок 8
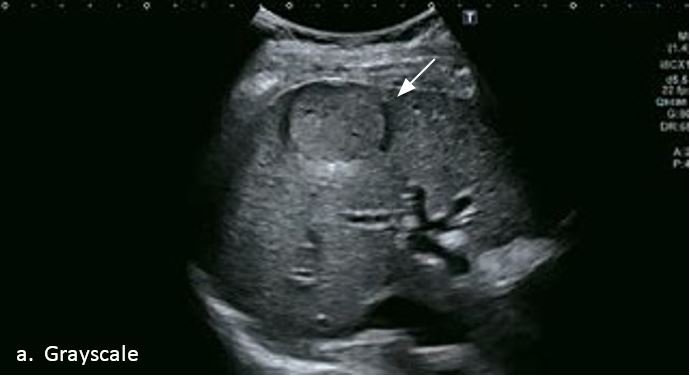
LI-RADS 5 ГЦК
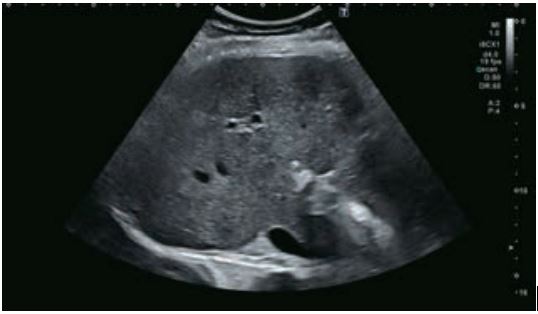
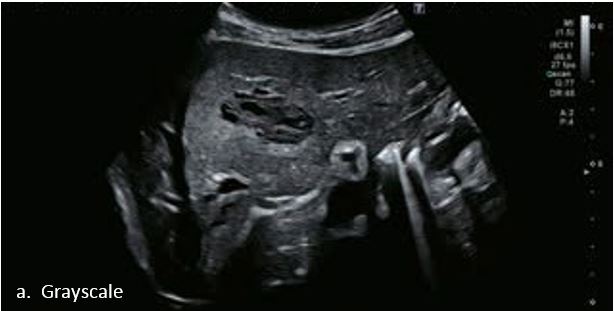
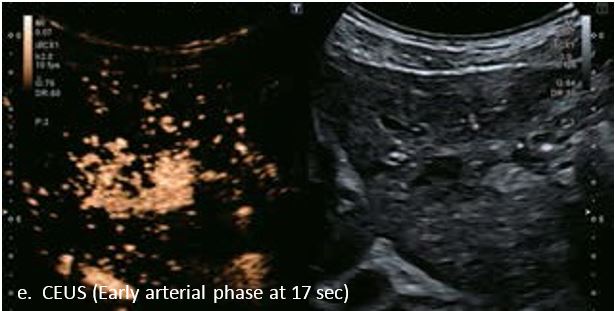
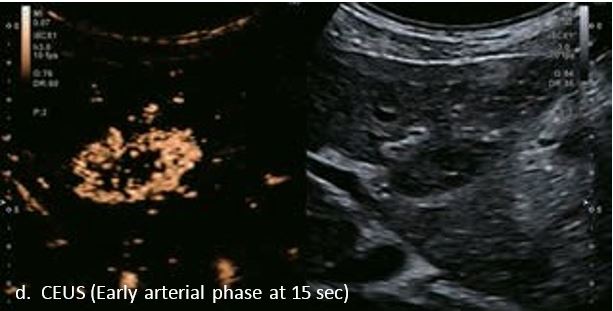
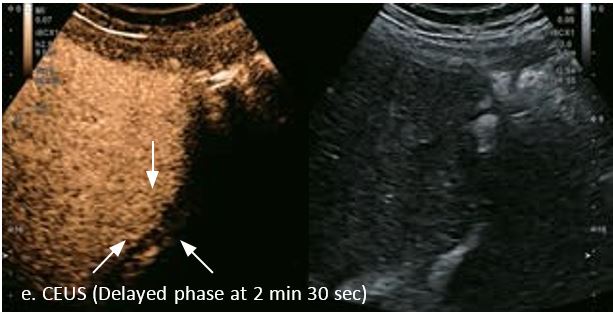
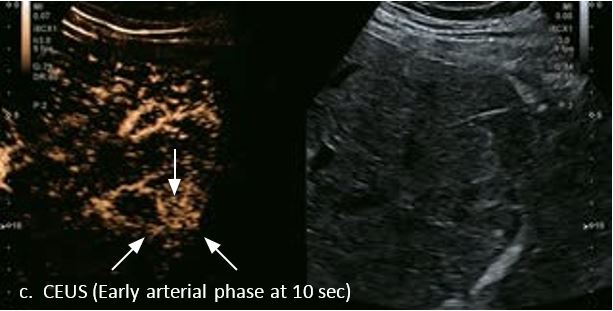
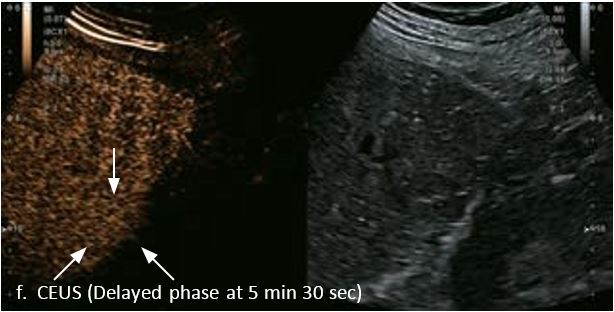
У 63-річної жінки з алкогольним цирозом печінки виявлено ураження печінки розміром 3 см. Межа ізоехогенного ураження та його гіпоехогенний ореол може бути чітко відображений на сірошкальному зображенні. За допомогою кольорового доплера можна виявити внутрішньопухлинну судинну структуру. Багата судинна структура може бути окреслена за допомогою SMI, та можуть бути показані викривлені судини, що свідчить про злоякісне ураження. Після ін'єкції контрасту, в артеріальній фазі, ураження демонструє гомогенне гіперпосилення, пов'язане з підживлюючими судинами. Вимивання не спостерігається на 1 хвилині і на 2 хвилині. У відстроченій фазі на 3,5 хвилині можна спостерігати помірне вимивання. Вимивання повільно прогресує і стає більш чітким на 5 хвилині. Пізнє (≥ 60 сек) і помірне вимивання є однією з основних ознак LI-RADS 5 і є дуже важливим для диференціації від LI-RADS M, який показує раннє (<60 сек) і/або виражене вимивання. В результаті ураження класифікується як CEUS LI-RADS 5. Класифікація CEUS LI-RADS відповідає LI-RADS на КТ.
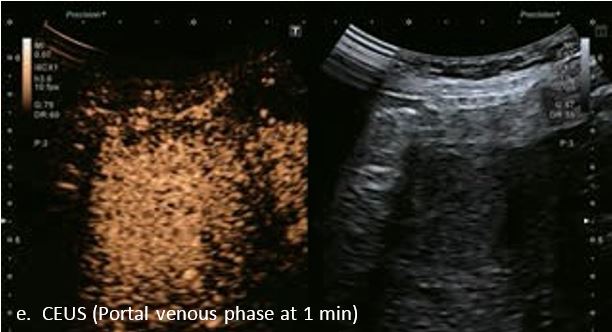
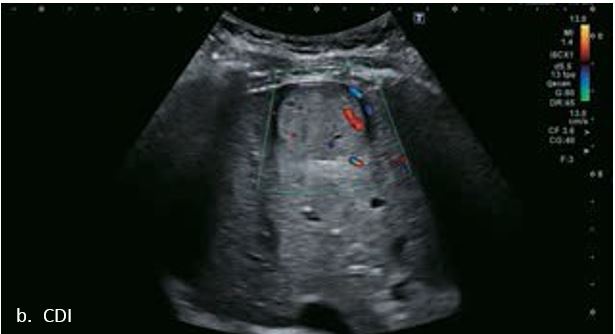
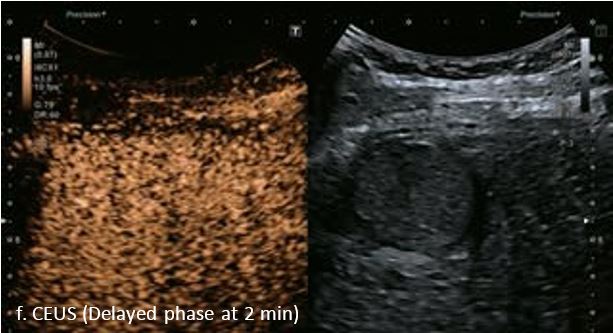
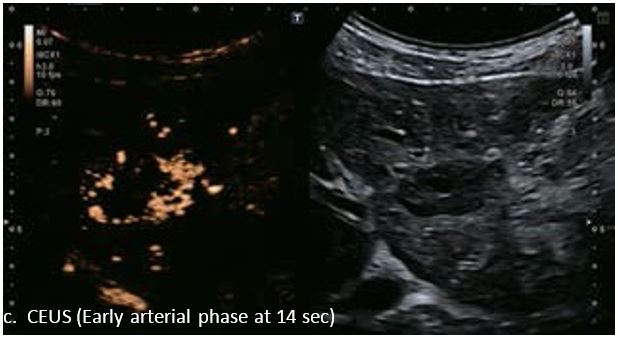
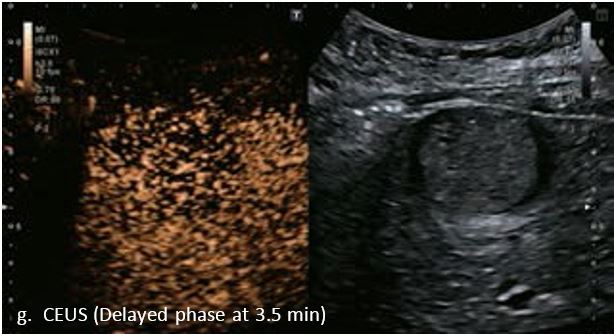
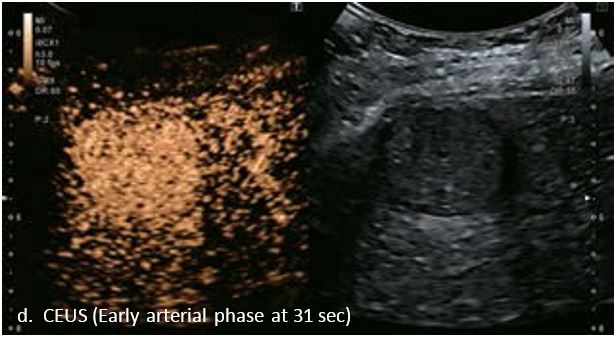
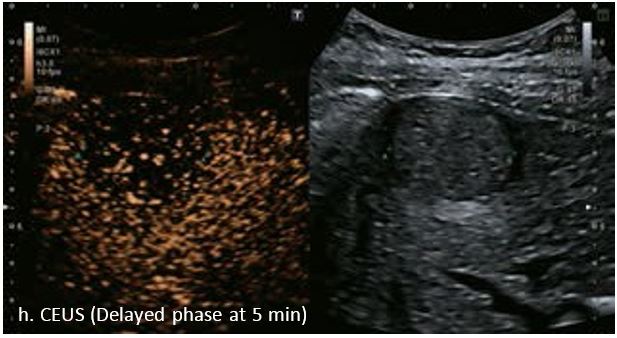
Малюнок 9
Оцінка результатів лікування ГЦК
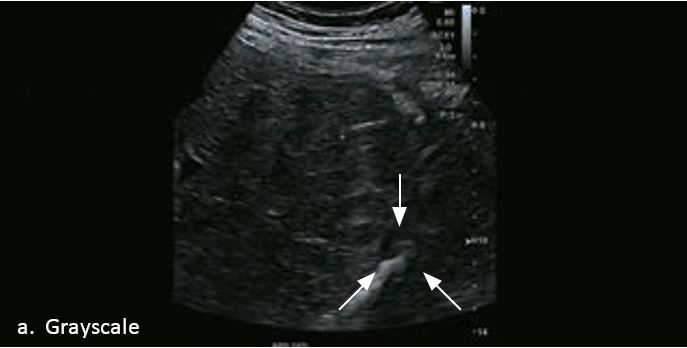
Проведено повторне обстеження 79-річного чоловіка з цирозом печінки В, ускладненим ГЦК, після транс-артеріальної хіміоемболізації (ТАХЕ). Було виявлено нове ураження, розташоване поруч з ураженням після ТАХЕ. На сірошкальному зображенні чітко видно нове ураження, але складно виявити рецидив ГЦК в зоні ураження після ТАХЕ. За допомогою кольорового картування SMI (cSMI) можна побачити розвинену судинну мережу всередині нового вогнища ураження. Для оцінки результату лікування було виконано CEUS. За допомогою CEUS можна легко дослідити як нове ураження, так і рецидив ГЦК у вогнищі ураження після TACE. Нове ураження демонструє гіперпосилення артеріальної фази і відсутність вимивання до 5 хвилин, отже, це ураження LI-RADS 4, ймовірна ГЦК за критеріями LI-RADS. Підживлюючі судини можна чітко спостерігати в ранній артеріальній фазі. Для ураження після TACE, більша його частина не підсилюється, однак, в артеріальній фазі спостерігається ділянка гіперпосилення у верхній частині лікованого ураження, що вказує на рецидив ГЦК.
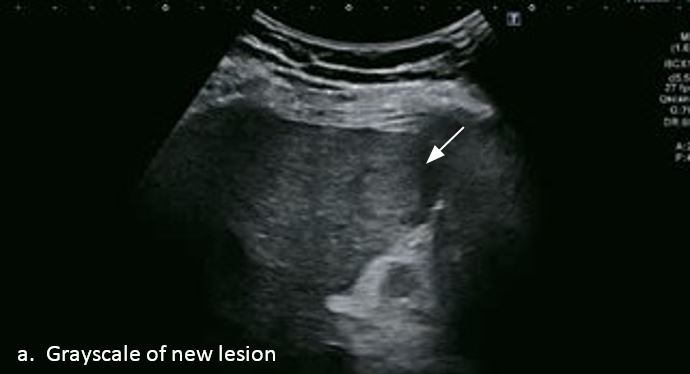
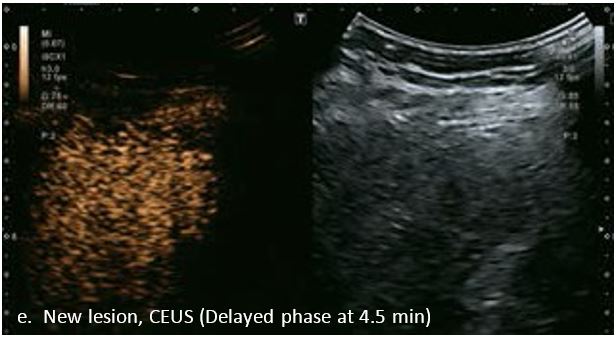
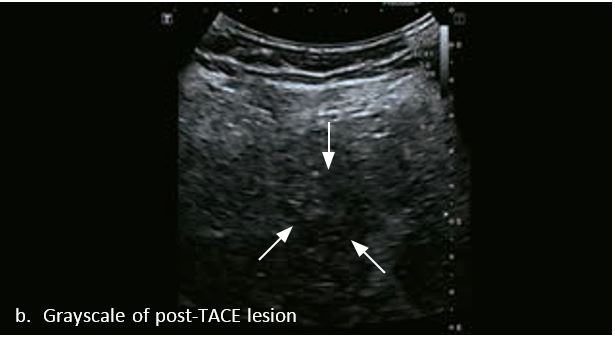
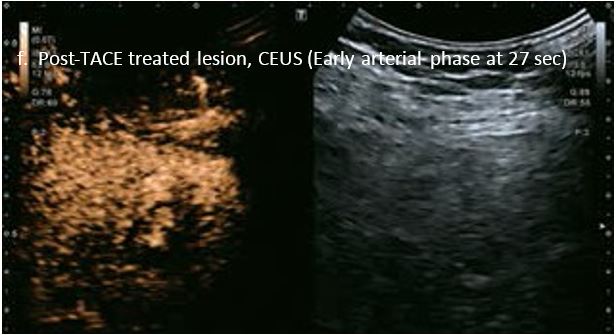
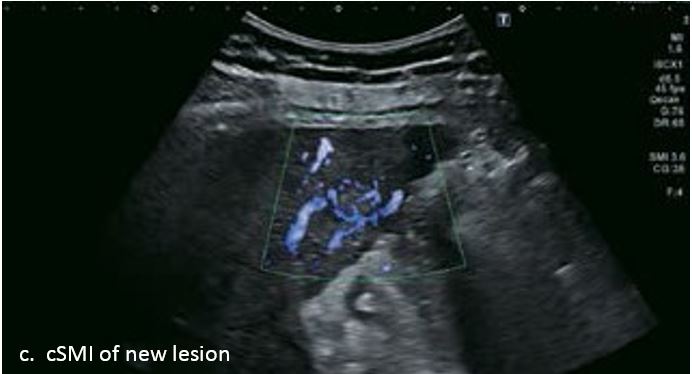
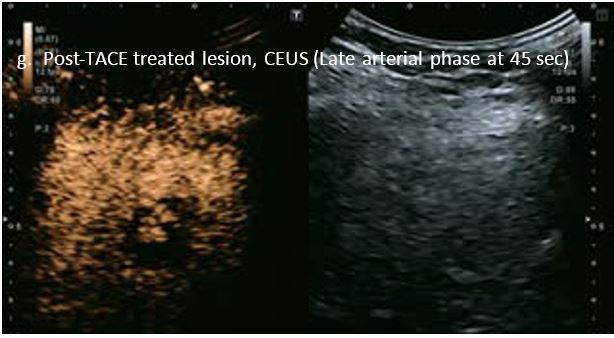
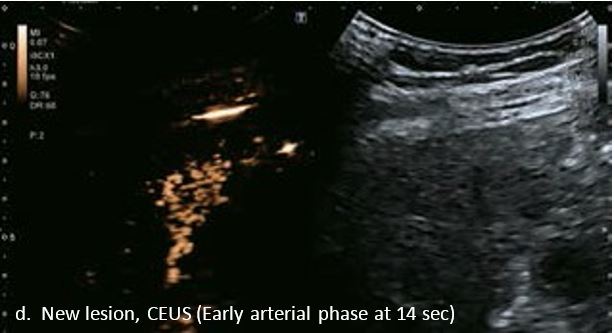
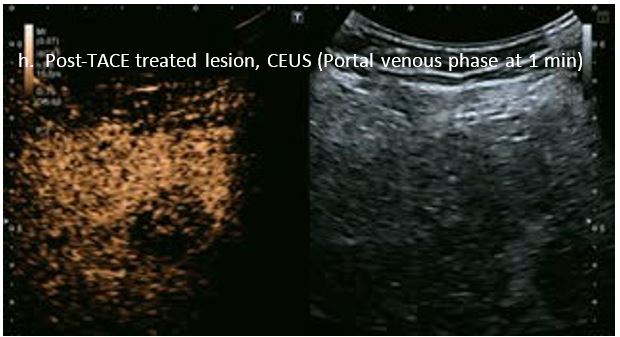
Малюнок 10
LI-RADS 4 множинні ГЦК
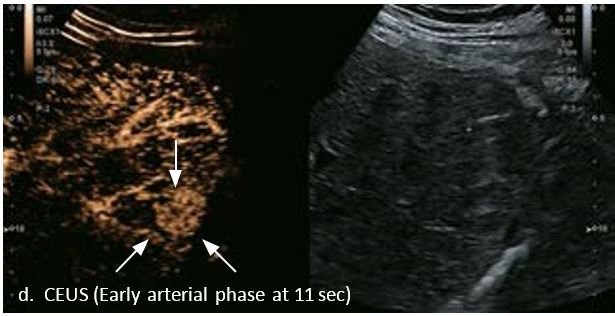
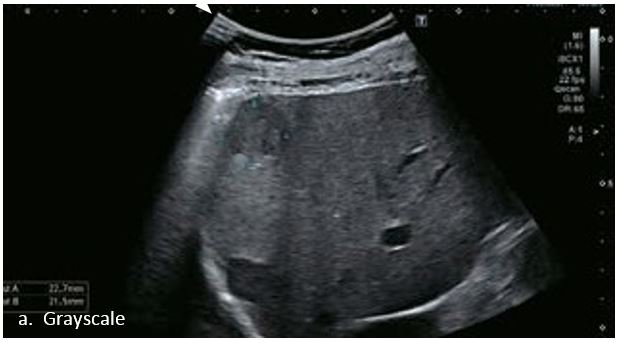
Це випадок 60-річної жінки з декомпенсованим цирозом печінки з асцитом. На сірошкальному зображенні можна виявити два вогнищевих ураження, розміром 21 мм і 10 мм відповідно, розташовані в сегменті 5. Оскільки дослідження методом зсувної хвилі на апараті Canon виконується штовхаючим імпульсом, пацієнтам з асцитом не можна проводити дослідження за допомогою зсувної хвилі, для визначення стадії фіброзу. На ранній артеріальній стадії гомогенне гіперехогенне підсилення спостерігається в обох ураженнях. Ураження є ізоехогенними в портальній венозній та пізній фазах, вимивання не спостерігається через 6 хвилин після ін'єкції, тому ці ураження були класифіковані як LI-RADS 4, ймовірна ГЦК. Важливо знати, що LI-RADS 5 - це ГЦК зі 100% вірогідністю, і вона не потребує біопсії. Значна кількість LI-RADS M (ймовірно або точно злоякісні, але не специфічні для ГЦК) і LI-RADS 4 (ймовірна ГЦК) насправді являються ГЦК.
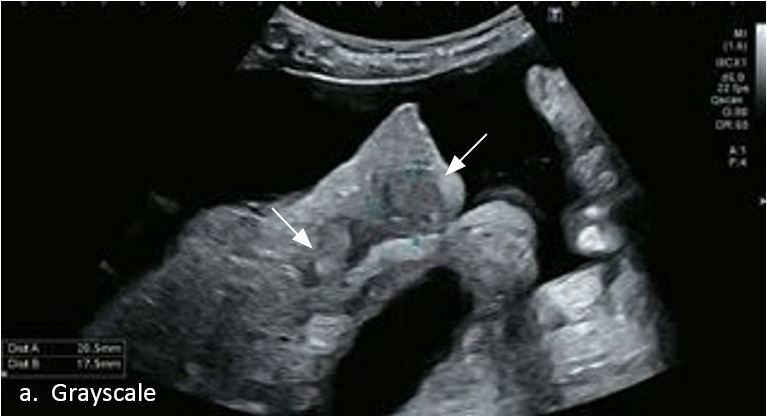
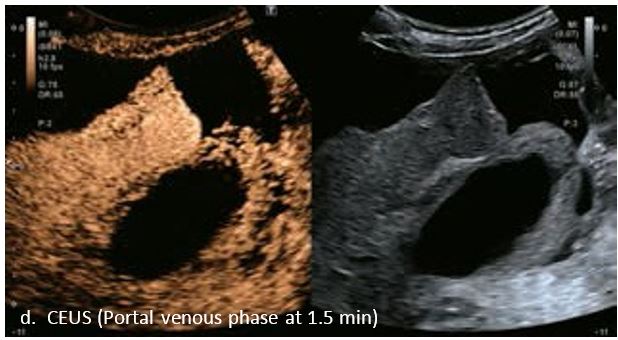
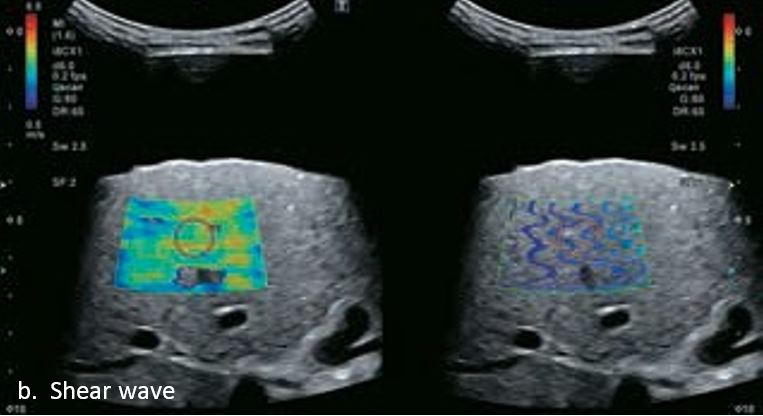
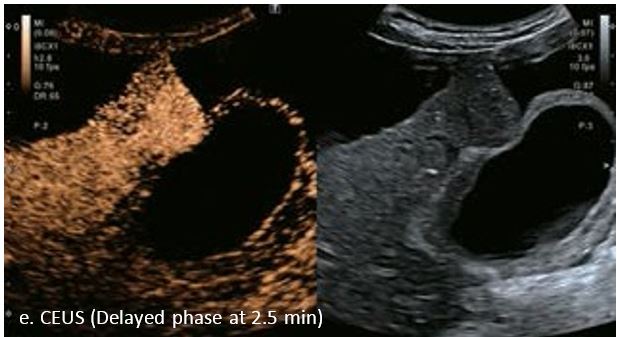
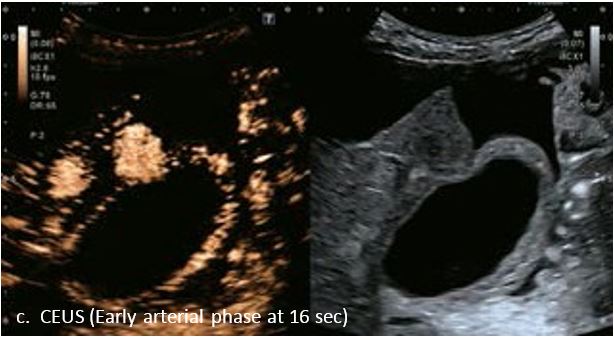
Малюнок 11
LI-RADS 5 з декількома ГЦК
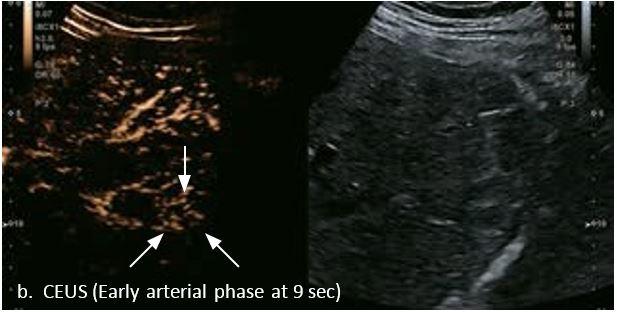
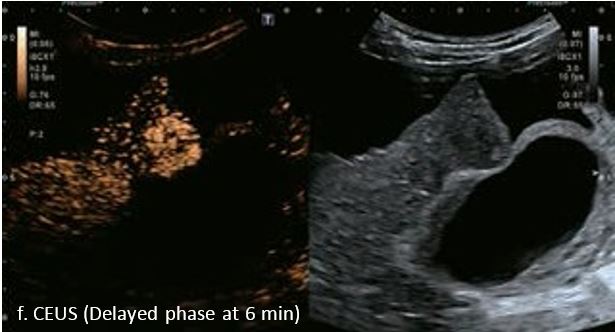
У 70-річної жінки з цирозом печінки, хворої на вірусний гепатит С, у правій частці печінки виявлено вогнище ураження розміром 23 мм. Детальна судинна структура та підживлююча судина чітко візуалізуються за допомогою CEUS на ранній артеріальній фазі та під час портальної венозної фази, а ураження є ізопідсилюючим. Це ураження є типовим для LI-RADS 5 за своїм розміром, гіперпосиленням в артеріальній фазі та пізнім і помірним вимиванням, що спостерігається через 3 хвилини після ін'єкції.
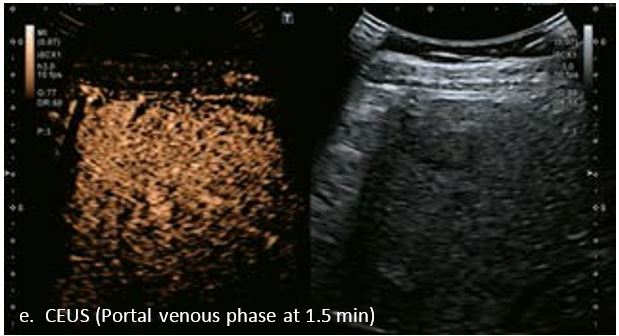
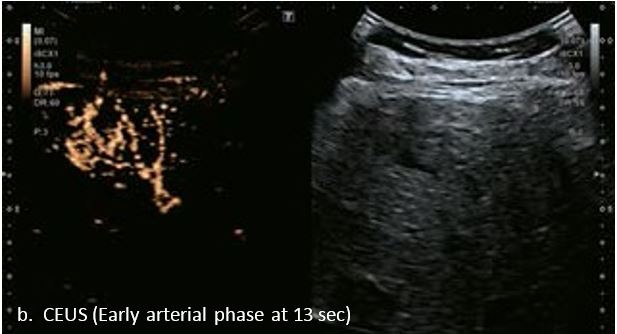
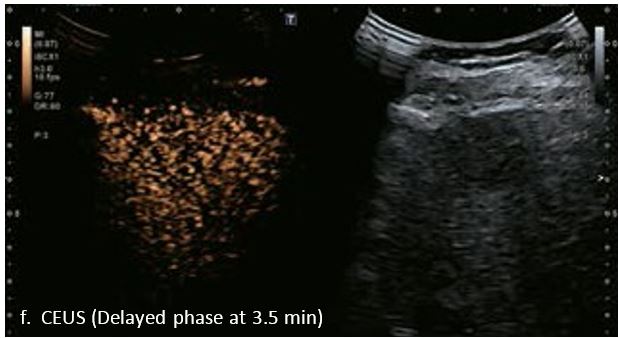
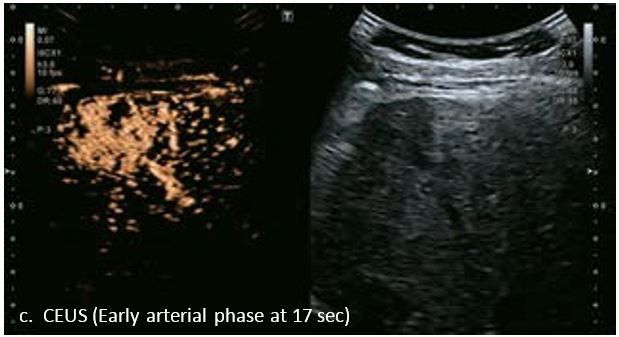
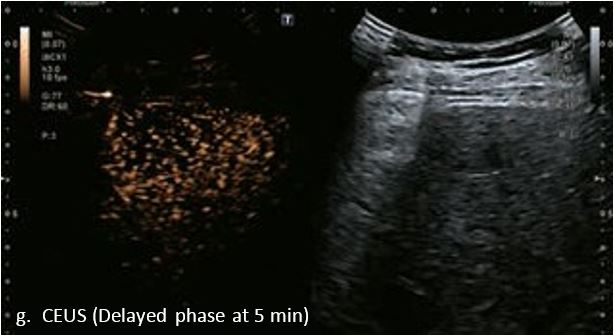
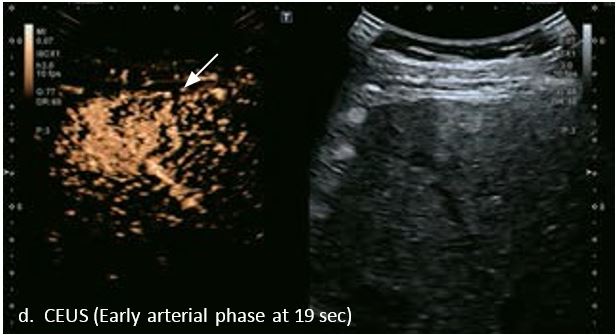
Малюнок 12
Висновок
Системи Aplio i-серії забезпечують безпрецедентну чіткість і деталізацію зображень, значно покращуючи при цьому глибину проникнення для подолання труднощів при візуалізації пацієнтів з ожирінням і невеликих ГЦК. Хороша якість зображення навіть у пацієнтів з ожирінням має вирішальне значення для поліпшення результатів спостереження за ГЦК.
Покращена тканинна супресія забезпечує точну і швидку діагностику при диференціації злоякісності вогнищевого ураження печінки, і CEUS LI-RADS® може точно діагностувати категоризацію. Діагностична ефективність і продуктивність значно покращуються завдяки високій якості зображення. Крім того, нещодавно розроблені інтерфейс і дизайн системи забезпечують відмінну ергономіку для користувачів.
CEUS є економічно ефективним методом класифікації вогнищевих уражень печінки без іонізуючого випромінювання у дорослих та дітей. Для пацієнтів з гострими та хронічними ураженнями нирок існує високий ризик розвитку контрастної нефропатії, спричиненої контрастними речовинами для КТ, та нефрогенного системного фіброзу, спричиненого контрастними речовинами на основі гадолінію для МРТ, у той час як CEUS є безпечною альтернативою, оскільки не є нефротоксичним. Реформа охорони здоров'я трансформує систему охорони здоров'я Сполучених Штатів від об'ємно-орієнтованої до вартісно-орієнтованої. Оскільки цей перехід триває, CEUS для визначення вогнищевих уражень печінки може стати прикладом економічно ефективного і високоякісного клінічного інструменту.
Посилання
1. National Cancer Institute. Surveillance, Epidemiology, and End Results Program. Accessed 11, 2016, from http://seer.cancer.gov/
2. Centers for Disease Control and Prevention. Expected New Cancer Cases and Deaths in 2020. Accessed 11, 2016, from
http://www.cdc.gov/cancer/dcpc/research/articles/cancer_2020.htm
3. Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma. The Lancet. 2003;362:1907–1917.
4. American Liver Foundation. Non-Alcoholic Fatty Liver Disease. Accessed 11, 2016, from http://www.liverfoundation.org/abouttheliver/info/nafld/
5. Bruix J, Sherman M. AASLD Practice Guideline: Management of Hepatocellular Carcinoma: An Update. Accessed 11, 2016, from
http://www.aasld.org/sites/default/files/guideline_documents/HCCUpdate2010.pdf
6. Andersson, Karin L., et al. "Cost effectiveness of alternative surveillance strategies for hepatocellular carcinoma in patients with cirrhosis." Clinical Gastroenterology and Hepatology 6.12 (2008): 1418-1424.
7. Singal A, Volk ML, Waljee A, et al. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther 2009;30:37-47
8. American College of Radiology. Liver Imaging Reporting and Data System (LI-RADS). Accessed 11, 2016, from http://www.acr.
org/quality-safety/resources/LIRADS
Останні новини та події
