АКЦІЇ! ПЕРЕГЛЯНУТИ ПОВНИЙ ПЕРЕЛІК ДОСТУПНИХ ПРОПОЗИЦІЙ МОЖНА ТУТ
Категорії новин:
Репродуктивна функція та оцінка раннього терміну вагітності. Частина 1
Білл Сміт, керівник відділу ультразвукової діагностики
CDS Clinical Diagnostic Services, Лондон, Велика Британія
Вступ
Фізіологічні процеси, які контролюють або впливають на репродуктивний період - різноманітні. Ендокринні фактори, дуже важливі для дозрівання яйцеклітини, запліднення та розвитку ембріону, є досить складними. Вони контролюють циклічні зміни рівнів гормонів та статевих гормонів, необхідних для репродуктивного циклу.
Звичайне 2D/3D трансвагінальне ультразвукове дослідження (далі ультразвукове дослідження) не дозволяє провести кількісну оцінку фізіологічних змін, на відміну від біохімічного аналізу сироватки крові. Однак вдосконалення технології ультразвукового дослідження продовжує підвищувати здатність розпізнавати та розуміти анатомічні фактори, особливо ті, що стосуються яєчників та матки, які відображають вищезазначене.
Яєчник є надзвичайно динамічним органом, який постійно змінюється протягом репродуктивного періоду життя. Його основні функції полягають у виробленні зрілих яйцеклітин для запліднення, а також у виробленні специфічних стероїдних гормонів, а саме естрогенів і прогестеронів.
УЗД показує значні морфологічні зміни в яєчнику, пов'язані з овуляційним статусом, фертильністю та розвитком вагітності на ранніх термінах. Крім того, вона забезпечує детальне дослідження ендометрію, цільового органу, зокрема для естрогенів та прогестеронів, що секретуються яєчниками, а також залози, відповідальної за підтримку та сприяння процесу запліднення. УЗД дозволяє розпізнати характерні ультразвукові ознаки ендометріальної строми та пов'язані з нею зміни на певних стадіях менструального/репродуктивного циклу.
Здатність ультразвуку оцінювати фізіологічні зміни ще більше посилюється завдяки досягненням у кольоровій доплерівській візуалізації, зокрема SMI (Superb Microvascular Imaging). SMI визначає судинні зміни в тканинах, які відображають гормональну активність. Вона показує ангіогенацію (судинне утврення) як частину ендометріальної проліферації та утворення плаценти. Дослідження підтверджують, що периферична васкуляризація фолікула в період овуляції, яка виявляється за допомогою технології SMI, точно відображає гормональну функцію яєчника.
Сучасні ультразвукові технології, які включають 2D- та 3D-візуалізацію з високою роздільною здатністю у сірій шкалі та SMI-візуалізацію, відіграють вирішальну роль в оцінці ключових елементів репродуктивного циклу. Вони надають важливу клінічну інформацію, що стосується овуляційного циклу та фертильності, розпізнавання порушень овуляції та оцінки перебігу ранньої вагітності та пов'язаних з нею ускладнень. Крім того, вони здатні розпізнавати функціональні проблеми, особливо ті, що походять від яєчників і пов'язані з гормональною активністю. Функціональні розлади залишаються основною причиною гінекологічних симптомів, таких як аномальні маткові кровотечі та/або біль у нижній частині живота.
Яєчники
Яєчник в основному складається з 3 анатомічних компонентів: капсули яєчника(фолікули та строми), кори яєчника та мозкової речовини(сполучна тканина, судини й нерви) яєчника. В ультразвуковому дослідженні кору та мозкову речовину разом називають стромою яєчника. Кора яєчника залишається основним об'єктом ультразвукового дослідження – вона містить величезну кількість фолікулів, що містять ооцити.
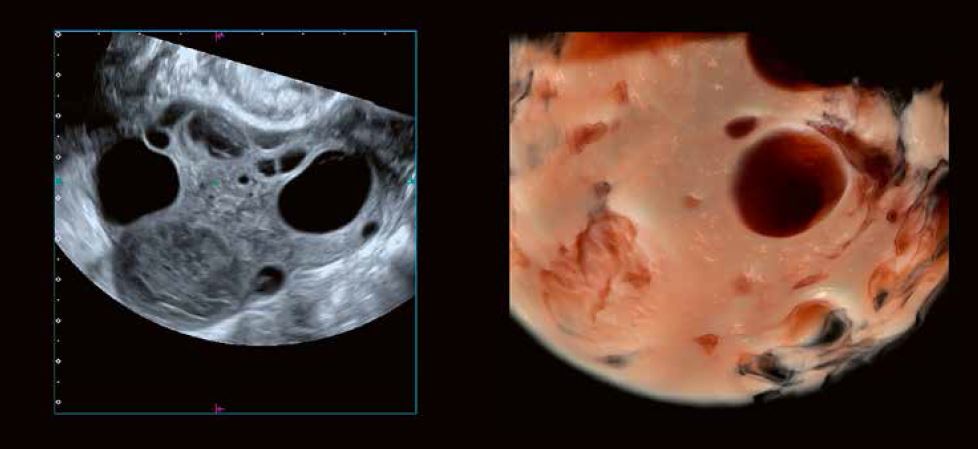
Рис. 1: Детальне зображення морфології яєчників за допомогою 3D-реконструкції в сірій шкалі та візуалізації Shadow Glass відповідно. Розширена 3D-візуалізація візуалізує стійку, заповнену згустками лютеїнову кісту, незрілі фолікули перед овуляцією, антральні фолікули, а також атретичні фолікули та залишки фолікула, що пройшов овуляцію.
Протягом усього циклу між початком менструації та менопаузою кора яєчників підтримує фолікули на різних стадіях розвитку. Ті, що видно на ультразвуковому дослідженні, варіюються від багатьох антральних фолікулів до ряду незрілих фолікулів і, як правило, одного домінантного передовуляційного (граафського) фолікула (рис. 1 + 3).
Ультразвукові властивості яєчників значно варіюються відповідно до морфологічних змін, що відбуваються залежно від віку та кількості пологів. Анатомічні висновки, отримані в результаті масштабного спостережного дослідження, проілюстровані на рисунку 2.
10 000 пацієнток у віці від 15 до 60 років були обстежені за допомогою 3D (об'ємної) трансвагінальної ультразвукової діагностики.
Результати стосуються ультразвукових ознак, що спостерігаються в середині проліферативної фази менструального циклу.
Яєчники мають характерну «багатофолікулярну» структуру після настання статевої зрілості і, як правило, залишаються такими до настання вагітності або до настання середнього віку у жінки. Спостерігається тенденція до збільшення розміру фолікулів з відповідним зменшенням їх кількості на цій стадії овуляційного циклу, яка триває протягом усього репродуктивного періоду життя.
Ця зміна у структурі фолікулів супроводжується одночасним розвитком строми яєчників. Зміни, зображені на рис. 2, добре відповідають коливанням рівнів ФСГ та АМГ у сироватці крові, особливо у старших вікових групах.
Описані зміни у структурі фолікулів/строми часто можуть бути пов'язані з клінічними проблемами. Ультразвукові характеристики так званих яєчників з синдромом полікістозних яєчників (СПКЯ) добре задокументовані, але можуть бути пов'язані з іншими формами овуляторних/менструальних проблем. Дійсно, «нормальні» багатофолікулярні зміни, що спостерігаються у віковій групі підлітків та молодих жінок до 25 років, відповідають ультразвуковому визначенню СПКЯ, як зазначено в рекомендаціях ESHRE/ASRM Rotterdam Consensus! Багатофолікулярні яєчники зі зниженою активністю строми часто зустрічаються у випадках гіпоталамо-гіпофізарної дисфункції або недостатності і, як правило, пов'язані з використанням оральних контрацептивів або навіть факторами способу життя.
Багатофолікулярні яєчники, особливо на пізній стадії репродуктивного періоду, часто асоціюються з менорагією та іншими менструальними проблемами, які часто супроводжуються «домінуванням естрогену».
Розуміння морфологічних змін у яєчнику у зв'язку з функцією яєчників (ендокринною функцією) є надзвичайно важливим у дослідженні гінекологічних захворювань, а також у галузі репродуктивної медицини.
Капсула яєчника оточує строму яєчника. 3D (об'ємна) трансвагінальна УЗД забезпечує точне окреслення капсули та рівномірність її товщини. Зазвичай вона виглядає як тонкий, рівномірний шар. Гістологічно вона складається з зародкового епітелію з покриваючим шаром сполучної тканини (біла оболонка). Протягом циклу не спостерігається значних змін у зовнішньому вигляді. Посилене потовщення, як було доведено, пов'язане з СПКЯ. Локальна нерівномірність може бути спричинена патологічними змінами, такими як ендометріоз, злоякісні новоутворення яєчників тощо.
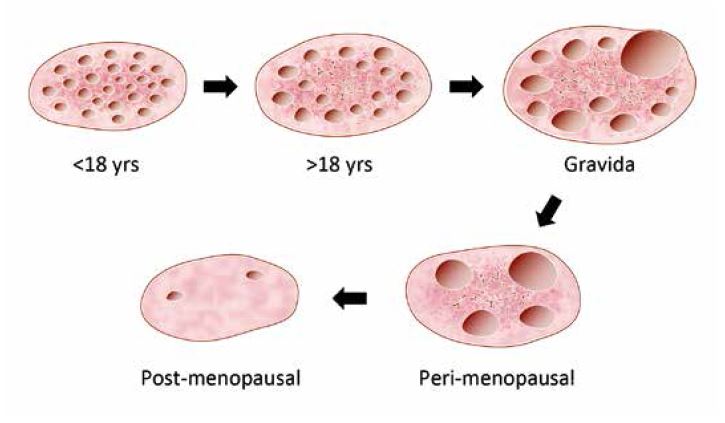
Рис. 2: Зміни в структурі фолікулів яєчників та строми з віком та кількістю пологів. Висновки великого дослідження з використанням 3D (об'ємного) трансвагінального ультразвукового дослідження.
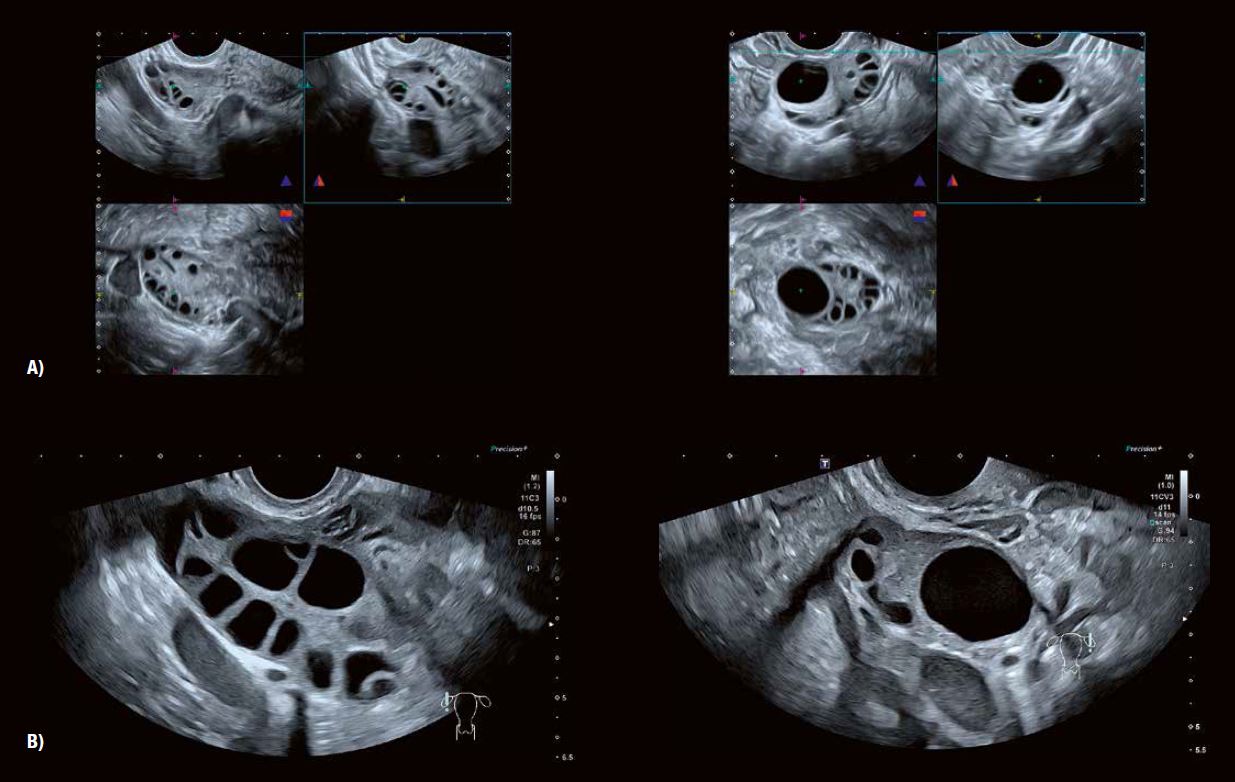
Рис. 3 A: 3D анатомічні площини показують типову мультифолікулярну природу структури фолікулів яєчників у віковій групі від раннього до середнього та пізнього підліткового віку.
Рис. 3 B демонструє зміну характеристик фолікулів та строми у жінок, наприклад, у віці від 25 до 39 років, особливо після пологів.
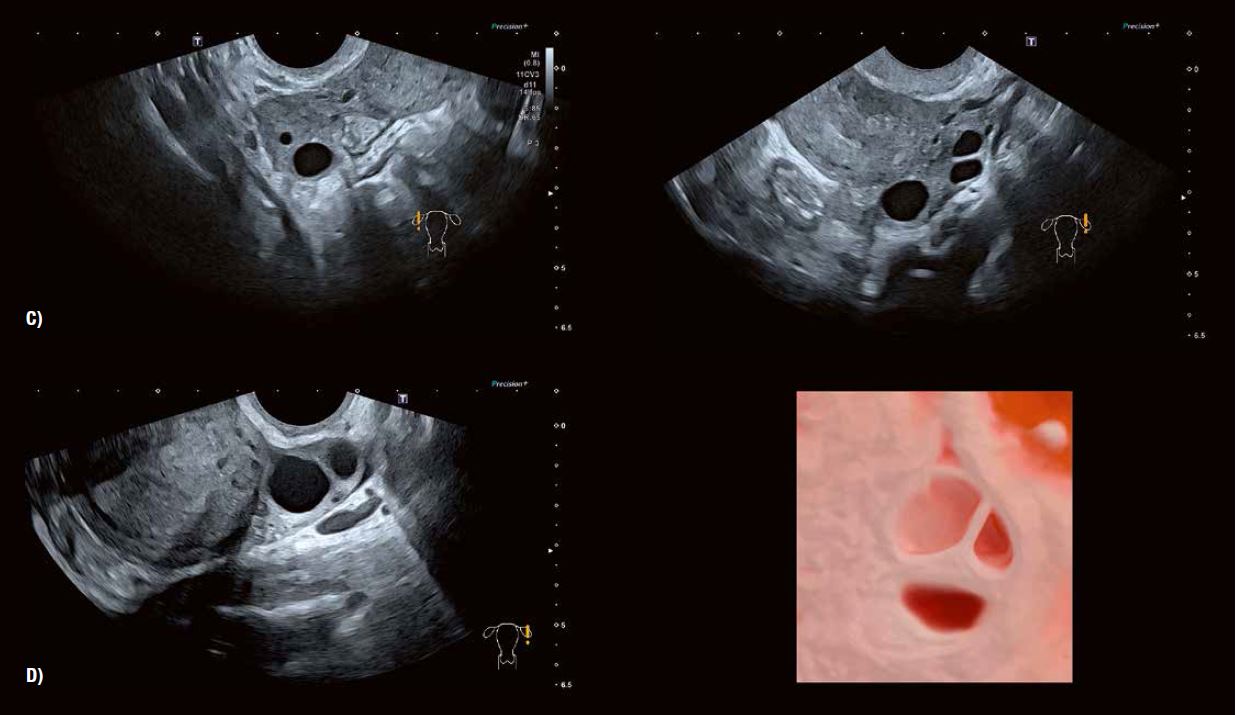
Рис. 3 C: Типовий вигляд у віковій групі 40 років.
Рис. 3 D: 2D- та 3D-зображення (Luminance) показують фолікули жінок у віці від 45 до 50 років. На відтвореному зображенні чітко видно контури фолікулів, що складаються з гранульозних та текальних клітинних шарів.
Медула утворює внутрішню, центральну частину строми яєчника. Вона складається переважно із сполучної тканини, що містить основну нервово-судинну мережу яєчника. Судини та нерви входять у строму медулли в ділянці воріт яєчника. Візуалізація судин воріт за допомогою SMI (рис. 4) часто допомагає ідентифікувати та визначити місцезнаходження яєчника. Це стосується візуалізації неактивних яєчників, особливо у випадках поганої функції яєчників або у пацієнток у постменопаузі.
Кора містить початкові фолікули і підтримує їх перехід до преантральної стадії розвитку в рамках росту і дозрівання фолікулів. Фолікул на цій стадії складається з щільної або первинної ооцити, оточеної гранульозними клітинами, інкапсульованими комірцем клітин, що називаються текальними клітинами. Збільшення товщини гранульозних і текальних клітин відбувається з утворенням центрального скупчення рідини. Ці зміни призводять до утворення антрального фолікула.
«Кістозний» вигляд дозволяє візуалізувати антральні фолікули розміром від 2 до 3 мм. Розмір антральних фолікулів коливається від 2 до 8 мм. Підрахунок антральних фолікулів, що проводиться перед процедурами ЕКЗ або для оцінки фолікулярного запасу яєчників у пацієнток в періоді менопаузи, точно вимірюється за допомогою 3D УЗД вагінальним датчиком проводиться приблизно на 3–5 день циклу після початку менструації.
Ультразвукове дослідження та моніторинг росту фолікулів під час природного або пов'язаного з допоміжними репродуктивними технологіями циклу вже давно стали загальноприйнятою практикою. Прогрес у технології УЗД значно підвищив можливості оцінки дозрівання фолікулів та прогнозування початку овуляції (рис. 5). Сканування у високій роздільній здатності в сірій шкалі демонструє потовщення стінки фолікула внаслідок розвитку гранульозних та текальних клітин. Внутрішнє відшарування гранульозних клітин можна виявити в овуляційному фолікулі. 3D-візуалізація Fly Thru часто дозволяє розпізнати кумулюсну масу безпосередньо перед овуляцією (рис. 6). Розмір фолікула на початку овуляції може варіюватися від 1,8 до 3,0 см. Примітка: розмір фолікула сам по собі не завжди є показником його дозрівання.
SMI показує збільшення периферичної васкуляризації, пов'язаної з дозріванням фолікулів (Граафа). Він також дозволяє точно виміряти час овуляції в рамках циклу, що контролюється. Було доведено, що підвищена васкуляризація пов'язана з овуляційним статусом і розвитком сприятливого ендометрію в періоді овуляції (рис. 5 + 6). Дослідження показали хорошу кореляцію між периферичним ангіогенезом фолікула в періоді овуляції та після овуляції з рівнями естрогену та прогестерону в сироватці крові відповідно. SMI забезпечує надійний засіб оцінки функції лютеїнової фази як частини моніторингу фертильності та оцінки дуже ранньої вагітності (рис. 9+13).
Пост-овуляційний фолікул, або жовте тіло, може сильно відрізнятися за зовнішнім виглядом і імітувати патологічні ураження. Периферичний кровотік навколо ураження дуже помітний, особливо на початку та в середині лютеїнової фази. Він зменшується в циклах без зачаття протягом тижня, що передує менструації, з поступовим зникненням ураження. Це відповідає зниженню рівня прогестерону, що виробляється яєчниками, що призводить до менструації приблизно через 14 днів після овуляції в типовому циклі. У разі настання вагітності жовте тіло залишається інтактним і активним.
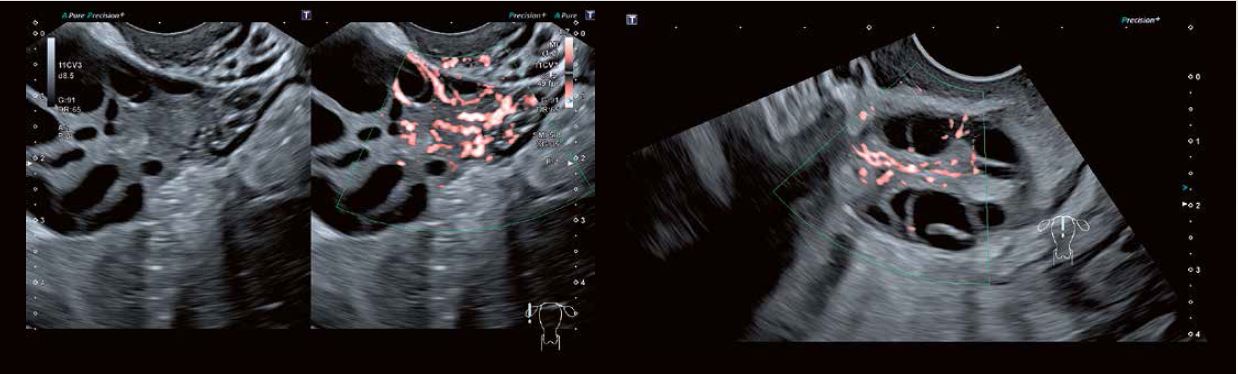
Рис. 4: SMI чітко демонструє верхівку яєчників та нормальний розподіл судин яєчників у медулярній стромі яєчників у окремих пацієнток.
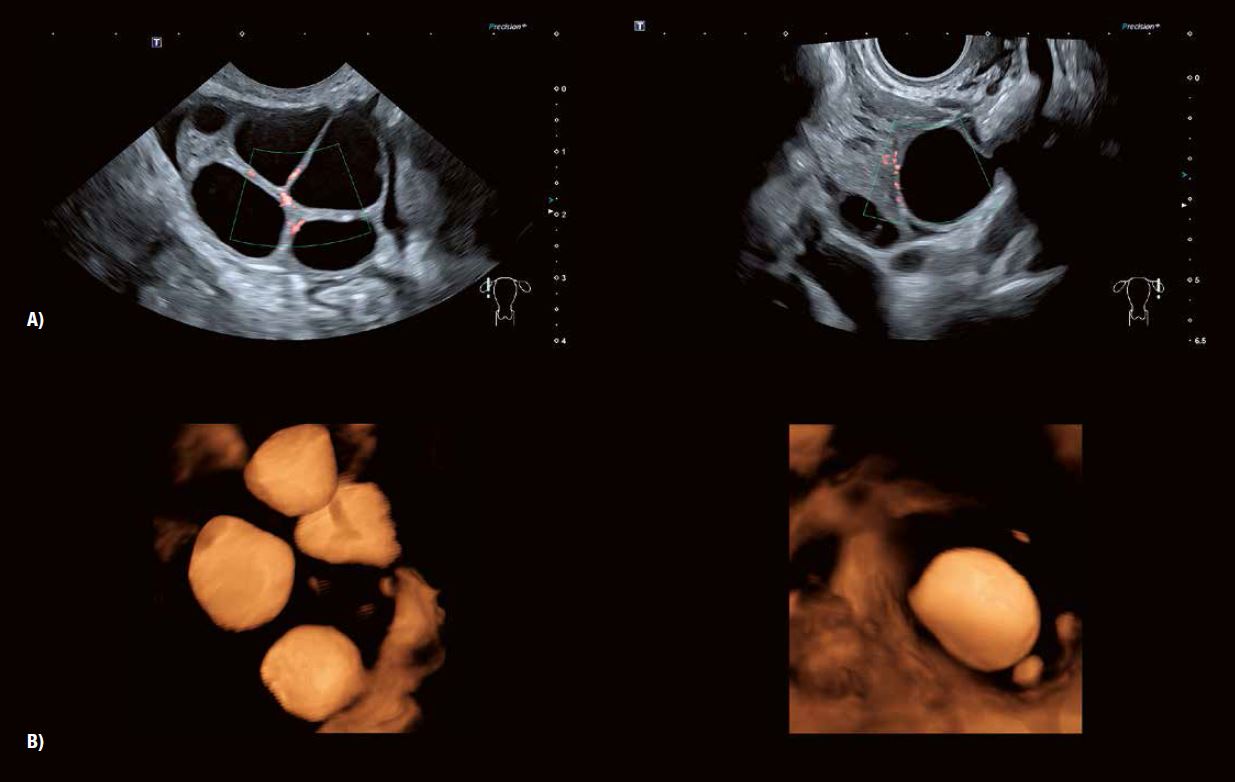
Рис. 5 A: SMI визначає периферичний ангіогенез, пов'язаний із дозріванням фолікулів після стимуляції яєчників.
Рис. 5 B: 3D-візуалізація поверхні чітко окреслює фолікули на обох яєчниках.
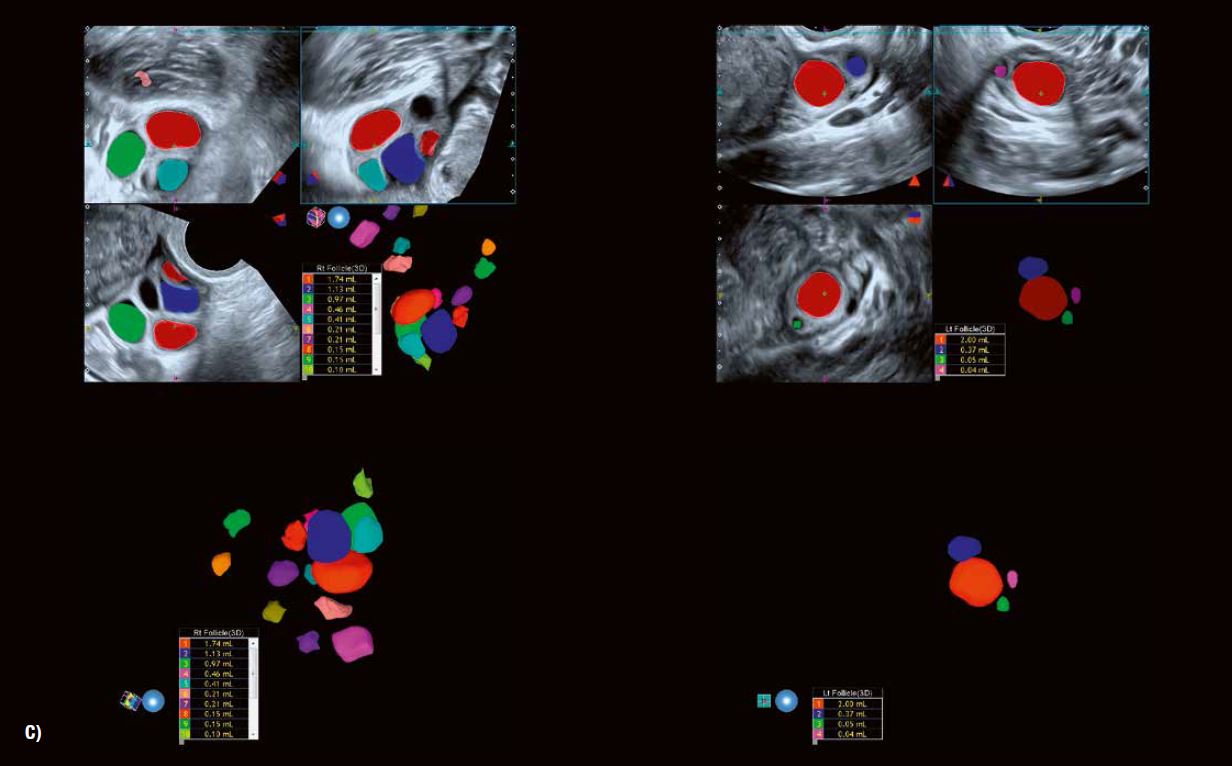
Рис. 5 C: Автоматичне вимірювання об'єму фолікулів із функцією кольорового кодування має очевидну перевагу з точки зору моніторингу циклів допоміжних репродуктивних технологій що забезпечує дуже ефективну оцінку кількості фолікулів, а також їх зростання.
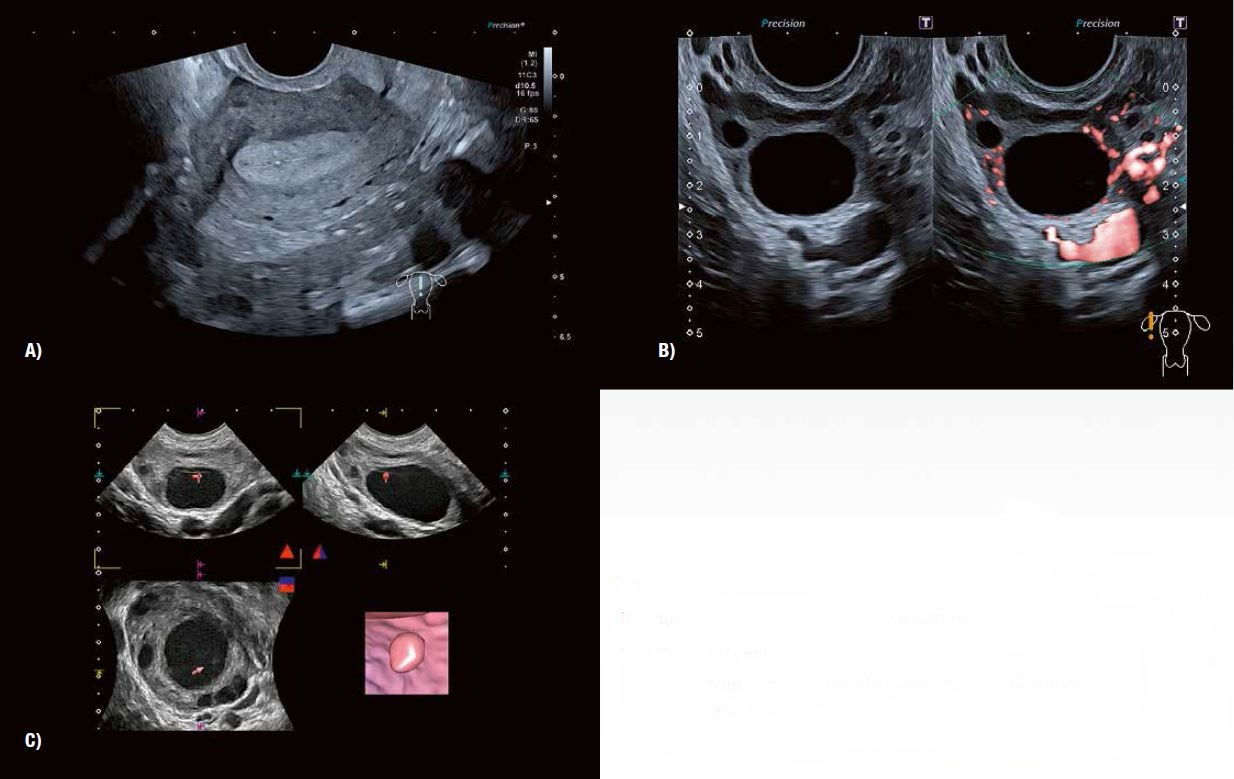
Рис. 6 А: Сприятливий вигляд ендометрію через 24–30 годин після ін'єкції препарату, що стимулює овуляцію.
Рис. 6 Б: SMI підтверджує наявність активного, зрілого фолікула перед овуляцією, що призводить до змін ендометрія в період овуляції, описаних на рис. 6 А.
Рис. 6 В: Зображення Fly Thru демонструє ймовірну масу кумулюса, що вільно плаває у фолікулярній рідині перед овуляцією.
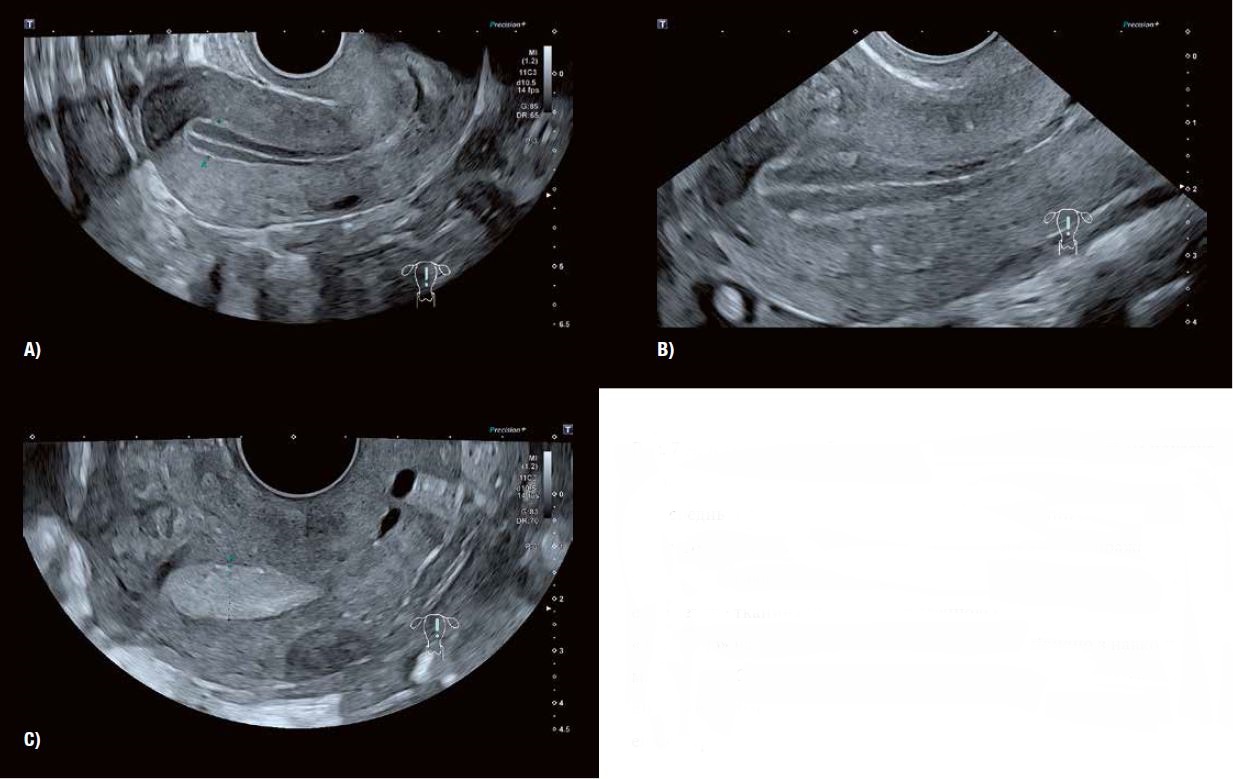
Рис. 7 A, B і C: Серія зображень втрансвагінальним датчиком показує характерні зміни в зовнішньому вигляді ендометрію під час переходу від середньої фази проліферації (A) до фази овуляції (B) і ранньої фази жовтого тіла (C). Зміна характеристик сірої шкали відображає стадії проліферації залоз у стромі ендометрію. У міру збільшення залоз ендометрію тканина стає більш ехогенною і «яскравою» на ультразвуковому зображенні порівняно з навколишнім міометрієм. Сучасна візуалізація трансвагінальним датчиком у сірій шкалі виключає термін «тришаровий» для опису циклічного розвитку ендометрі.
- Tags:
- Ультразвукові системи
Останні новини та події
